Zinātnieks Frīdrihs Kohlrauss (1840-1910) bija pirmais, kurš ierosināja, ka tīrs ūdens vada elektrību, kaut arī nelielā apjomā. Tas notiek tāpēc, ka ūdens uzvedas amfoteriski; tas ir, dažos gadījumos tas darbojas kā skābe, ziedojot protonus (H+); un citos tas izturas kā bāze, saņemot protonus.
Tas nozīmē, ka ūdens veic savu jonizāciju saskaņā ar zemāk parādīto ķīmisko vienādojumu:
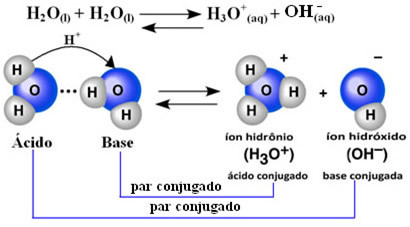
Šo procesu sauc ūdens autoionizācija un tas notiek ļoti mazā mērogā, tas ir, ūdens ir ļoti vājš elektrolīts, ar zemām jonizācijas pakāpes vērtībām un jonizācijas konstantu līdzsvarā (Kç). Tieši tāpēc ūdenim ir tik zema vadītspēja.
Lai iegūtu priekšstatu, apkārtējā temperatūrā 25 ° C ir iespējams noteikt, ka tīra ūdens pašjonizācijā radušās hidroksīda un hidronija jonu koncentrācijas ir vienādas ar 1. 10-7 mol. L-1. Tas nozīmē, ka no miljarda ūdens molekulu tikai divas jonizē.
Tiek saukta ūdens jonu līdzsvara konstante çūdens disociācijas konstante,autoprotolīzes konstantevai jonu ūdens produkts.Šo konstanti attēlo Kw, jo w attiecas uz vārdu ūdens, kas angļu valodā nozīmē ūdens.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Tās aprēķins tiek veikts tāpat kā citas līdzsvara konstantes, atceroties to, kā teikts tekstā " Bilance Kc un Kp ”, šajā gadījumā izteiksmē parādīsies tikai produkti, jo ūdenim šķidrā stāvoklī ir tāda pati aktivitāte līdz 1. Tīras šķidras vai cietas vielas netiek iekļautas disociācijas nemainīgajā izteiksmē, jo tās nemainās. Tiek ievietoti tikai ūdens un gāzveida šķīdumi. Tātad mums ir:
Kw = [H3O+]. [ak-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Tāpat kā ar citām līdzsvara konstantēm, labiw tas mainās tikai mainoties temperatūrai. Palielinoties ūdens temperatūrai, palielinās arī tā jonizācija, kas nozīmē, ka ūdens pašjonizācija ir endotermisks process, tas ir, tas absorbē siltumu.
To var redzēt ūdens jonu produkta vērtībās (Kw), kas doti zemāk esošajā tabulā dažādās temperatūrās:
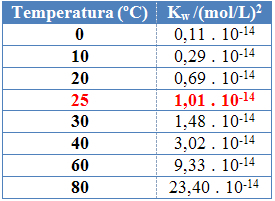
Ūdens jonu produktam katrā temperatūrā vienmēr būs noteikta vērtība, tīrā ūdenī vai šķīdumā. Pat ja šķīdumā ir H jonu koncentrācija3O+ un ak- atšķirīgs, produkts starp tiem paliks nemainīgs.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Joniskā ūdens produkts (Kw)"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Piekļuve 2021. gada 28. jūnijam.

