Karbonāti ir neorganiski savienojumi, kas veidojas, metālu vai pusmetālu jonu savienojot ar karbonāta anjonu, CO32-.
Ogleklis ir četrvērtīgs, tas ir, tā valences apvalkā ir četri elektroni, un tas var padarīt četras kovalentās saites stabilas, kamēr skābeklis ir divvērtīgs, valences apvalkā ir seši elektroni un tas spēj izveidot divas saites, lai tās būtu stabilas, ar astoņiem elektroni. Tādējādi ir spēcīga tendence, ka ogleklis savienojas ar diviem skābekļa atomiem, kuri visi ir stabili (O ═ C ═ O → CO2).
Bet cits skābeklis var apvienoties ar oglekli, jo jonu rādiusu attiecība noved pie koordinācijas skaitļa, kas vienāds ar 3, veidojot struktūru trīsstūrveida, kurā ogleklis atrodas centrā, izveidojot dubultu saiti ar vienu no skābekļa atomiem un divas atsevišķas saites ar pārējiem diviem oxygens. Rezultāts ir divi liekie elektroni, jo šie divi oksigēni nav stabili, un katram no tiem jāsaņem viens elektrons:
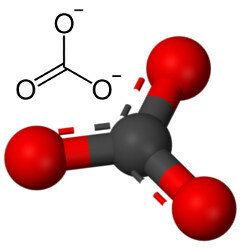
Karbonāta anjonu veido kovalentās saites, bet tā savienojumus, kas ir neorganiski sāļi un minerāli pazīstami kā karbonāti, ir jonu, jo šis radikāļš saņem divus elektronus no kāda metāla vai pusmetāla, veidojot a jonu saite.
Šie savienojumi ūdenī nešķīst, izņemot amonija karbonātu ((NH4)2CO3) un karbonāti, kas veidoti ar sārmu metāliem (1. saimes elementi: Li, Na, K, Rb, Cs un Fr). Gandrīz visas ir baltas cietas vielas, kā parādīts zemāk esošajā attēlā:

Divi visbiežāk sastopamie un vissvarīgākie karbonātu ikdienas piemēri ir nātrija karbonāts (Na2CO3) un kalcija karbonāts (CaCO3). Pirmajā gadījumā nātrijs pieder pie 1. saimes, jo valences apvalkā ir elektrons un tam ir tendence zaudēt šo elektronu, lai tas kļūtu stabils. Tā kā karbonāta anjonam jāsaņem divi elektroni, tas saistās ar diviem nātrija atomiem:
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)

Soda pelni ir labāk pazīstami kā soda vai soda, un tos izmanto ziepju, krāsvielu, zāļu, papīra ražošanā un peldbaseina ūdens apstrādē. Bet stikla ražošanā to galvenokārt izmanto kalcija karbonātā un smiltīs.
Kalcijs ir 2. ģimene, kurai ir tendence zaudēt divus elektronus. Tādējādi kalcija atoms saistās ar karbonāta radikāli:

Kalcija karbonāts ir kaļķakmenī un marmorā. Plkst stalaktīti un stalagmīti kas pastāv alās, sastāv no šī karbonāta; čaumalas, koraļļu rifi un olu čaumalas arī. Balinot sienas, koku stumbrus un citas vietas, mēs izmantojam kalcija hidroksīdu (Ca (OH)2), kas laika gaitā reaģē ar atmosfēras oglekļa dioksīdu, veidojot kalcija karbonātu.

Karbonāti ir ļoti izplatīti uz zemes virsmas, tāpat kā minerālu gadījumā. Tās kristāliskais tīklojums kosmosā var pārkārtoties divos veidos: ortorombisks (kā tas ir gadījumā ar minerālvielu aragonītu, kas parādīts iepriekš kopā ar kalcija karbonāta formulu) un romboedrāls vai trigonāls, tāpat kā kalcīts (cits minerāls, kas sastāv no kalcija karbonāta).
Karbonāti reaģē skābju klātbūtnē, atbrīvojot CO2, kas ir viegli redzams caur putošanu.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Dženifera Roka Vargasa. "Karbonāti"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/carbonatos.htm. Piekļuve 2021. gada 28. jūnijam.
Ķīmija

Nātrija karbonāts, Leblanc metode, Ernesta Solvaja metode, soda soda, soda, parastā stikla ražošana, peldbaseina ūdens apstrāde, ūdens pH kontrole, tekstila apstrāde, pārtikas piedeva.
Ķīmija

Ikdienas sāļi, kalcija karbonāts, nātrija hlorīds, nātrija fluorīds, kālija nitrāts, nātrija nitrāts nātrijs, nātrija karbonāts, nātrija bikarbonāts, nātrija bikarbonāts, nātrija sulfīts, sāls soda.



