Organiskos savienojumus var attēlot dažādos veidos, piemēram, plakana strukturālā formula, vienkāršota vai saīsināta strukturālā formula vai domuzīmes formula. Tomēr vienkāršākais attēlojums ir molekulārā formula.

Tādējādi redzēsim, kā noteikt organisko savienojumu molekulāro formulu, pamatojoties uz citām iepriekšminētajām formulām.
1. Izmantojot plakano strukturālo formulu:šī formula parāda atomu izvietojumu vai izvietojumu molekulā. Piemēram, zemāk ir viena no benzīnā esošajiem ogļūdeņražiem plakana strukturālā formula.

Ņemiet vērā, ka šajā formulā tiek parādīti visi atomi un visas esošās saites starp tiem. Tagad, lai noteiktu šī savienojuma molekulāro formulu, vienkārši saskaitiet katra elementa atomu skaitu un ievietojiet indeksu attiecīgā elementa apakšējā labajā pusē.
Svarīgs aspekts, kas jāuzsver, ir tas mēs vienmēr sākam organisko savienojumu molekulāro formulu no oglekļa elementa, jo tā ir galvenā šo vielu sastāvdaļa. Skatiet piemēru:
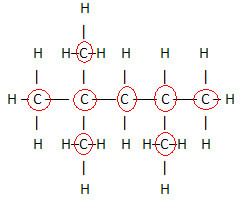
Tā kā ir 8 ogles, mēs sākam rakstīt molekulu formulu šādi: Ç8
Lai pabeigtu šo formulu, mēs saskaitām ūdeņražu daudzumu:
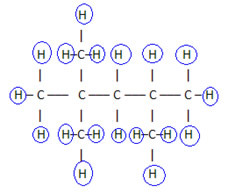
Tātad jūsu molekulārā formula é Ç8H18.
2. Izmantojot vienkāršoto vai saīsināto strukturālo formulu: šāda veida formulās ūdeņraža daudzums ir saīsināts. Piemēram, aplūkojiet to pašu molekulas formulu benzīnā, kas tagad ir kondensēts:
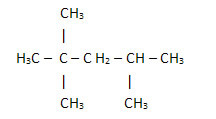
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Tādā veidā ir vēl vieglāk uzskaitīt ūdeņražu daudzumu, vienkārši pievienojiet indeksus (3 +3+ 3 +2 +1 +3 +3 = 18).
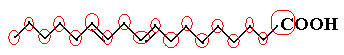
Bet tagad apskatīsim kondensēto linolskābes strukturālo formulu, kas pastāv dārzeņos, piemēram, kokvilnā, sojas pupās, saulespuķēs utt. un ko izmanto krāsās un lakās:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2- COOH
Skaitot ogļūdeņražu, ūdeņražu un oksigēnu daudzumu, mums ir šādi molekulārā formula linolskābes: Ç18H32O2.
3. Izmantojot insulta formulu: šī formula vēl vairāk vienkāršo to, kā attēlot organiskos savienojumus, jo tā izlaiž C, CH, CH grupas2 un CH3.
Piemērs ir linola molekula, skatiet, kā tā izskatās:

Vispirms saskaitīsim ogļu daudzumu, atceroties, ka šajā formulā katru saiti starp ogļiem attēlo domuzīme. Tādējādi padomi, kā arī divi lēciena punkti atbilst oglekļa atomiem.
Tātad mums ir: Ç18
Tagad, lai uzskaitītu ūdeņražu daudzumu, mums jāatceras, ka ir domātas saites starp ogļūdeņražiem un ūdeņražiem, jo ir zināms, ka ogleklis veido četras saites; tādējādi trūkstošo saišu daudzums ir ūdeņraža daudzums, kas saistīts ar šo elementu.
Skatiet skaidrojumus zemāk:
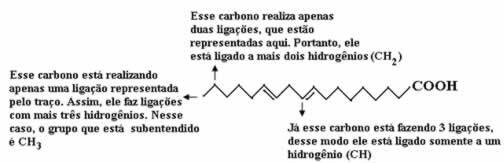
Tādējādi ūdeņražu daudzums būs: 32.

Skābekļa daudzumu ir diezgan vienkārši saskaitīt, jo ir tikai divi. Kopš molekulārā formula é: Ç18H32O2.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Organisko savienojumu molekulārās formulas"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm. Piekļuve 2021. gada 28. jūnijam.
Oglekļa telpiskā formula, Luisa elektroniskā formula, plaknes struktūra, elektroniskie pāri, saite kovalents, valences slānis, atoma modeļa attīstība, molekulārā formula, strukturālā formula, formulas trīsdimensiju.
Ķīmiskās formulas, plakana strukturālā formula, savienotāja strukturālā formula, trīskāršā saite, gāze slāpeklis, elektroniskā formula, Luisa formula, molekulārā formula, viena saite, dubultā saite, gāze oglekļa.


