Energijavidinis yra suma kinetinės energijos ir potencialas, susijęs su kūno atomų ir molekulių judėjimu. Vidinė energija taip pat yra tiesiogiai proporcinga energijai temperatūra kūno. Tai skaliarinis dydis, išmatuotas džauliais (SI) ir nustatytas kaip kintamųjų, tokių kaip spaudimas (P), apimtis (V) ir temperatūra sistemos termodinamika (T), Kelvine (K).
Kuo aukštesnė kūno temperatūra, tuo didesnė jo vidinė energija, tuo didesnis jo gebėjimas atlikti tam tikrą darbą. Be to, monoatominių dujų vidinę energiją, pavyzdžiui, suteikia išimtinai iš sumos kinetinė energija kiekvieno dujų atomo. Kalbant apie molekulines dujas, tokias kaip diatominės dujos, reikia atsižvelgti į molekulinę sąveiką ir, tai vidinę energiją lemia molekulių kinetinės energijos ir tarp jų esančios potencialios energijos suma jie.
Nesustokite dabar... Po reklamos yra daugiau;)
Idealių monoatominių dujų vidinė energija
Kadangi tarp idealių monoatominių dujų atomų nėra sąveikos, jų vidinė energija priklauso tik nuo dviejų kintamųjų: molių skaičiaus (n) ir dujų temperatūros (T). Žiūrėti:
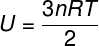
U - vidinė energija
ne - apgamų skaičius
R - universali tobulų dujų konstanta
T - temperatūra
Aukščiau pateiktoje lygtyje R jo modulis yra 0,082 atm. L / mol. K arba 8,31 J / mol. K (SI). Be to, aukščiau pateiktą lygtį galime parašyti pagal kitus dydžius, pvz., Slėgį ir tūrį. Tam turime prisiminti Clapeyrono lygtis, naudojamas idealioms dujoms.
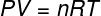
Pakeisdami aukščiau pateiktą lygtį ankstesnei, vidinei energijai apskaičiuoti turėsime šią išraišką:
Pažiūrėktaip pat:Kas yra tobulos dujos?
Atsižvelgiant į pirmiau pateiktas lygtis, galima nustatyti ryšį tarp idealių monoatominių dujų atomų kinetinės energijos ir jos temperatūros. Tam teigsime, kad šios rūšies dujų kinetinė energija yra grynaikinetika. Žiūrėti:
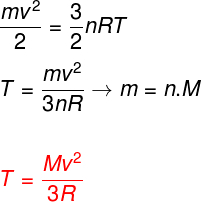
m - makaronai
ne - apgamo numeris
M - molinė masė
Daugeliu atvejų įdomu žinoti, kaip apskaičiuoti dujų vidinės energijos (ΔU) kitimą, nes šis kiekis parodo, ar dujos gavo arba pasidavė energijos. Jei dujų vidinės energijos pokytis buvo teigiamas (ΔU> 0), dujos bus gavusios energiją; priešingu atveju (ΔU <0) dujos bus atsisakiusios savo energijos.
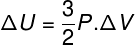
Vidinis energijos pokytis, kalbant apie dujų tūrio kitimą.
Vidinė diatominių dujų energija
Idealioms diatominėms dujoms vidinę energiją suteikia šiek tiek kitokia lygtis.
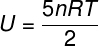
Vidinė energija termodinaminėse transformacijose ir cikluose
Pagal 1-asis termodinamikos dėsnis, idealių dujų vidinė energija gali skirtis termodinaminės transformacijos, atsižvelgiant į šilumos kiekį, kurį keičiama tarp aplinkos ir sistemos, taip pat nuo sistemos ar jos atlikto darbo.
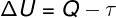
Klausimas - šiluma
τ - darbas
Toliau pažvelkime į formą, kurią šis dėsnis įgauna tam tikroms termodinaminėms transformacijoms.
Pažiūrėktaip pat:Terminių mašinų istorija
→ Vidinė energija: izoterminė transformacija
At izoterminė transformacija, temperatūros pokyčių nėra, todėl vidinė energija išlieka pastovi.
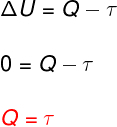
Tokiu atveju visas šilumos kiekis, kuris keičiamas su sistema, paverčiamas darbu ir atvirkščiai.
→ Vidinė energija: izovolumetrinė transformacija
At izovolumetrinė transformacija, atlikti darbų neįmanoma, nes sistema yra uždaryta kietame ir nebrangiame inde. Tokiu atveju visas šilumos kiekis, kuris keičiamas su sistema, tiesiogiai keičia jos vidinę energiją.
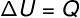
→ Vidinė energija: izobarinė transformacija
Tokio tipo transformacijos metu sistemai taikoma a pastovus slėgis, todėl jo ar jo atliktą darbą galima apskaičiuoti analitiškai.
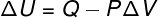
→ Vidinė energija: adiabatinė transformacija
Viduje konors adiabatinės transformacijos, tarp sistemos ir jos aplinkos nėra šilumos mainų, todėl vidinės energijos kitimas priklauso tik nuo sistemos ar jos atlikto darbo.
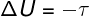
Vidinė energija cikliniuose procesuose
Kiekviename cikliniame procese sistemos termodinaminė būsena, išreikšta slėgio, tūrio ir temperatūros kintamaisiais (P, V, T), yra transformuojasi, bet galiausiai grįžta į pradinę būseną (P, V, T), todėl vidinės energijos kitimas tokio tipo procesuose visada yra nulinis (ΔU = 0).
Pažiūrėktaip pat:Ciklinės transformacijos
Pažvelkite į žemiau pateiktą grafiką, kuriame parodytos trys skirtingos termodinaminės transformacijos tarp būsenų A ir B.
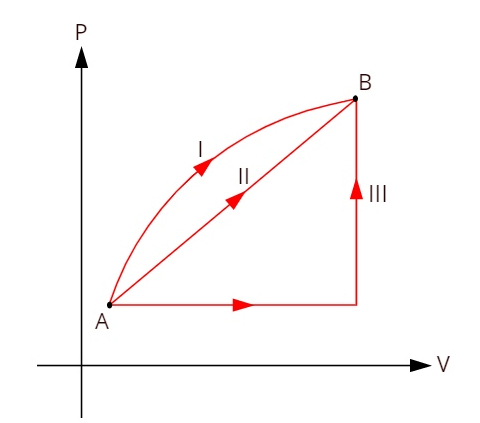
Kadangi trys transformacijos (I, II ir III) palieka A būseną ir eina į B būseną, vidinė energijos kaita joms visoms turi būti lygi, todėl:
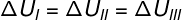
Vidinės energijos pratimai
1) Du idealių diatominių dujų moliai, kurių molinė masė lygi 24 g / mol, 500 K temperatūroje randami uždaroje, standžioje talpykloje, kurios tūris lygus 10-3 m³. Nustatyti:
a) Vidinis šių dujų energijos modulis džauliais.
b) slėgis, kurį dujos daro ant talpyklos sienelių.
Rezoliucija:
) Kadangi tai yra idealios ir diatominės dujos, jos vidinei energijai apskaičiuoti naudosime toliau pateiktą formulę:
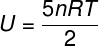
Atsižvelgdami į pratybų ataskaitoje pateiktus duomenis, turėsime išspręsti šį skaičiavimą:
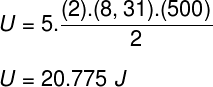
B) Mes galime nustatyti dujų slėgį, kai žinome jų talpos tūrį: 10-3 m³. Norėdami tai padaryti, naudosime šią formulę:
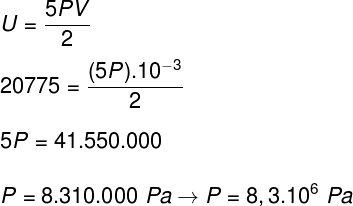
Mano. Rafaelis Helerbrockas