klapeirono lygtis yra matematinė išraiška, susiejanti tokius dydžius kaip spaudimas (P), tūris (V), temperatūra (T) ir dalelių (n), sudarančių a, skaičius tobulos arba idealios dujos. Ši lygtis pavadinta prancūzų fiziko vardu Pauliusemilisklapeironas ir gali būti suprantamas kaip empirinių dėsnių apibendrinimas dujospuikusįGay-Lussacas, Charlesas ir Boyle'as. Tai buvo labai svarbu tiriant idealias dujas ir leido evoliuciją Šiluminės mašinos, todėl pastaraisiais dešimtmečiais jie tapo vis efektyvesni.
Taip pat žiūrėkite: Fizikos atradimai, įvykę atsitiktinai
Clapeyrono lygtis: idealus dujų įstatymas
Clapeyrono lygtis yra išvestas iš trijų empirinių dėsnių, tai yra dėsniai, kurie buvo nustatyti iš eksperimentų. Tokie dėsniai paaiškina dujų elgseną dujų transformacijosizovolumetrinis (Gay-Lussac įstatymas), izobarinis (Karolio įstatymas) ir izotermai (Boyle'io dėsnis). Pagal šiuos įstatymus:
transformacijose izovolumetrinis, idealių dujų slėgio ir termodinaminės temperatūros santykis išlieka pastovus;
transformacijose izobarinis, idealių dujų tūrio ir termodinaminės temperatūros santykis yra pastovus;
- transformacijose izotermai, idealių dujų slėgio ir tūrio sandauga išlieka pastovi.
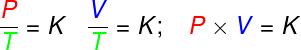
P - slėgis (Pa - pascal)
V - dujų tūris (m³)
T - termodinaminė dujų temperatūra (K - kelvinas)
Iš trijų aukščiau pateiktų dėsnių Clapeyrono lygtis nustato, kokia to vertė pastovus (K.) gautas atliekant kiekvieną iš minėtų transformacijų. Pagal Clapeyrono lygtį, ši konstanta lygi apgamų skaičiui, padaugintam iš a pastovus R, žinomas kaip visuotinė idealiųjų dujų konstanta ir lygi Boltzmanno konstanta padaugintas iš Avogadro numeris.
Formulė
Patikrinkite formulę, kuri yra žinoma kaip lygtisįKlapeironas:
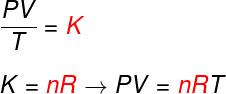
ne - apgamų skaičius (mol)
R - idealiųjų dujų universali konstanta (R = 0,082 atm.l / mol. K arba 8,314 J. mol / K)
Analizuojant Klapeirono lygtį, galima pastebėti, kad spaudimas kurį sukelia idealios dujos yra tiesiogiai proporcinga temperatūrai ir taip pat apgamų skaičius. Be to, slėgis yra atvirkščiai proporcingas tūriui užima dujos.
O idealus dujų modelis Clapeyron lygtis yra plačiai naudojama mašinų, sukurtų naudojant skysčių, pavyzdžiui, garo varomos mašinos ir vidaus degimo varikliai.
Keletą svarbių rezultatų būtų galima gauti iš Clapeyron lygties. Pavyzdžiui, vienas iš jų numato, kad 1 molis bet kokių idealių dujų užima tūrį 22,4 l kai veikiamas slėgio 1 atm (1,01.105 Pa) ir temperatūroje 273K (0 ° C).
Taip pat žiūrėkite: Svarbiausios termologijos sąvokos
Išspręstos Clapeyrono lygties pratybos
1 klausimas - (UECE) Dujos, kurių temperatūra, tūris ir slėgis priklauso nuo PV = nRT, turi šias charakteristikas:
a) labai didelis vidutinis atstumas tarp molekulių, kad būtų ignoruojama tarpmolekulinė sąveika, išskyrus susidūrimą; molekulės patiria elastingus susidūrimus.
b) labai mažas vidutinis atstumas tarp molekulių; molekulės patiria neelastingus susidūrimus.
c) labai didelis vidutinis atstumas tarp molekulių, kad būtų ignoruojama tarpmolekulinė sąveika, išskyrus susidūrimo atvejus; molekulės patiria neelastingus susidūrimus.
d) labai didelis vidutinis atstumas tarp molekulių ir stiprios tarpmolekulinės sąveikos; molekulės patiria elastingus susidūrimus.
Rezoliucija:
Idealiame dujų modelyje didelė dalis be dimensijų dalelių juda dideliu greičiu atsitiktinėmis kryptimis. Vienintelė šių dalelių sąveika yra visiškai elastingi susidūrimai, todėl teisinga alternatyva yra raidė A.
2 klausimas - (UFRGS) Apsvarstykite šiuos teiginius apie idealias dujas.
Aš Pastovioji R, esanti dujų būsenos lygtyje pV = nRT, turi tą pačią vertę visoms idealioms dujoms.
II. Vienodais skirtingų idealių dujų kiekiais, esant vienodai temperatūrai ir slėgiui, yra vienodas molekulių skaičius.
III. Idealių dujų molekulių vidutinė kinetinė energija yra tiesiogiai proporcinga absoliučiai dujų temperatūrai.
Kurios yra teisingos?
a) Tik aš
b) Tik II
c) Tik III
d) Tik I ir II
e) I, II ir III
Šablonas:
Pažvelkime į alternatyvas:
Aš teisingai, todėl ji vadinama visuotine idealių dujų konstanta.
II. teisinga. Pagal Clapeyrono lygtį, jei dviejų idealių dujų slėgis, temperatūra ir tūris yra vienodi, tada dalelių skaičius tose dujose yra vienodas.
III. teisinga. Pagal energijos ekvivalento teoremą, idealiųjų dujų dalelių kinetinė energija yra proporcinga jos temperatūrai.
Todėl teisinga alternatyva yra raidė e.
3 klausimas - (UFJF) Tokie vyrai kaip Clapeyronas, Boyle'as, Mariotte'as, Gay-Lussacas, van der Wallsas, be kita ko, sukūrė svarbius tyrimus, susijusius su dujų savybėmis. Tikrųjų dujų elgsena prilygsta idealioms dujoms esant žemo slėgio sąlygoms, taip pat didelėms dujoms ir aukštoje temperatūroje laikomoms dujoms. Atsižvelkite į tai, kad atliekant laboratorinius bandymus V tūrio indas yra visiškai uždarytas ir jame yra 1 molis idealių dujų esant 4,0 slėgiui. atm veikiamas pastovioje temperatūroje, lygioje 127 ° C, ir kad šios dujos elgiasi kaip idealios dujos, kaip parodyta grafinis.
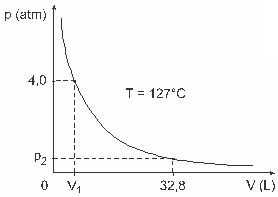
Tokiu atveju, kai dujos užima 32,8 l tūrį, jų sukeliamas slėgis bus:
(Duota: visuotinių tobulų dujų konstanta yra R = 0,082 atm. L / mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Rezoliucija:
C raidė
Norėdami išspręsti pratimą, turime pritaikyti duomenis pagal Klapeirono lygtį, tačiau prieš tai turime temperatūrą, kuri yra Celsijaus laipsniais, transformuoti į kelviną. Patikrinkite:

Autorius Rafaelis Hellerbockas
Fizikos mokytoja
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm
