Periodinės lentelės 17 arba VII A šeimos elementai vadinami halogenais, kuriuos žymi penki toliau išvardyti elementai: Fluoras (F), chloras (Cl), bromas (Br), jodas (I) ir Astatinas (At). Dažnai juos paprastai žymi raidė X.

Svarbiausi, atsižvelgiant į jų kasdienį naudojimą, yra chloras, bromas ir jodas.
Šis pavadinimas „halogenas“ reiškia „druskos formavimąsi“.
Visi jie turi 7 elektronus valentiniame apvalkale (elektroninis apvalkalas yra tolimiausias iki branduolio ir energingesnis). Paprastai: ns2 np5. Dėl to jie linkę gauti elektroną ir suformuoti neigiamus monovalentinius jonus (X-1), dažniausiai reaguoja su šarminiais metalais (1 šeimos metalais), kurie linkę dovanoti elektroną. Tokiu būdu jie sukelia junginius su MX tipo formulėmis.

Gaunant šį elektroną, halogenai yra stabilūs, nes jų valentinis apvalkalas yra pilnas (su aštuoniais elektronais) ir jų savybės visiškai pasikeičia. Pavyzdžiui, chloro dujos (Cl2) yra žalsvai geltonos, tankios, labai toksiškos ir reaktyvios dujos, mažai tirpios vandenyje ir sprogiai reaguojančios su vandeniliu. Tačiau kai
chloras (Cl) gauna elektroną iš natrio (Na), jie tampa jonais, susidaro natrio chloridas (NaCl) arba valgomoji druska, kurią mes suvartojame kasdien ir kuri yra būtina mūsų gyvenimui palaikyti. Chloras ypač tampa chlorido jonu (Cl-), kuri yra būtina mūsų organizme, kad susidarytų druskos rūgštis (HCl), pagrindinė skrandžio sulčių sudedamoji dalis.Iš tikrųjų chloras yra daugiausia halogenų ir naudojamas organiniams junginiams gaminti, neorganinės medžiagos, gaminant popierių (skirtą balinti celiuliozę) ir valant vandenį bei kanalizacijos. Taip pat įprasta naudoti vandeninį natrio hipochlorito (NaClO) tirpalą, kuris vadinamas „skystu chloru“ ir kurio sudėtyje yra baliklio.
Nesustokite dabar... Po reklamos yra daugiau;)
Įdomus faktas yra tas, kad nors kai kurie žmonės sako, kad baseinuose naudojamas „kietasis chloras“, iš tikrųjų tai yra ne tik chloro elementas, bet ir kalcio hipochloritas (Ca (ClO)2).
Be to, panašus atvejis yra fluoras - kuris iš tikrųjų yra ne fluoras per se, o fluoridai (joniniai junginiai, kuriuose yra fluoro elemento) - geriamojo vandens valymo priemonėse ir burnos priežiūros produktuose.
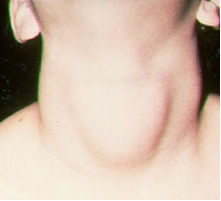
Dėl jodas, svarbus taikymas yra jų papildymas (jodidų arba natrio ir kalio jodatų pavidalu), kaip reikalaujama pagal įstatymą, į valgomąją druską. Taip yra dėl to, kad jodo trūkumas organizme gali sukelti ligą, vadinamą struma, liaudyje vadinamą papo.
O bromas tai yra raudonas, kambario temperatūros, skystis ir nestabilus skystis, kuris, būdamas lakus, gali išgaruoti ir sudaryti rausvą garą. Gamtoje jo nėra atskirai, taip pat jis nėra naudojamas pramonėje tokiu būdu. Pagrindiniai jo junginių panaudojimo būdai yra: kaip organinių reakcijų, sumaišytų su kuru, katalizatoriai, be kita ko, fotografuojant.
jau astatinas tai yra radioaktyvus elementas. Jo kilmė dažniausiai atsiranda dėl radioaktyvaus urano ir torio izotopų irimo. Jis sudaro mažiausiai 20 izotopų, o stabiliausias yra „At-210“, kurio pusinės eliminacijos laikas yra 8,3 valandos. Tai labai retas elementas.
Jennifer Fogaça
Baigė chemiją

