Yra trys natūralios radioaktyviosios emisijos: alfa (α), beta (β) ir gama (γ). Kai kurie mokslininkai toliau tyrė šių teršalų pobūdį ir buvo sukurti keli bendrieji radioaktyvumo dėsniai. Tarp šių mokslininkų vienas reikšmingas indėlis į natūralaus radioaktyviojo skilimo tyrimą buvo anglų fizikas ir chemikas Frederickas Soddy (1877–1956).

Pašto ženkle, išspausdintame Švedijoje apie 1981 m., Matomas 1921 m. Nobelio premijos laureato chemijoje Fredericko Soddy atvaizdas *
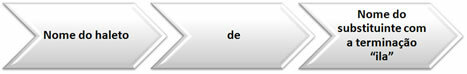
pirmasis radioaktyvumo dėsnis, taip pat žinomas kaip Pirmasis Soddy įstatymas, tai susiję su alfa skilimu. Pažiūrėkite, ką sako šis įstatymas:
“Kai atomas patiria alfa skilimą (α), jo atominis skaičius (Z) sumažina du vienetus, o masės skaičius (A) - keturis vienetus “.
Paprastai mes galime atstovauti šį dėsnį tokia lygtimi:
ZX →24α + Z-2A-4Y
Tai atsitinka su kiekvienu radioaktyviu elementu, skleidžiančiu alfa dalelę, nes kaip parodyta tekste Alfa emisija (α), šią dalelę sudaro du protonai ir du neutronai - panašūs į tai, kas vyksta su helio atomo branduoliu - ir ją vaizduoja24α.
Atomo skaičius (Z) yra toks pats kaip protonų skaičius. Taigi, išleidus alfa dalelę, prarandami du protonai, todėl atomų skaičius sumažėja dviem vienetais. Masės skaičius (A) atitinka protonų ir neutronų sumą. Kadangi alfa dalelėje yra du protonai ir du neutronai, masės skaičius sumažėja keturiais vienetais, kai branduolys išskiria tokią dalelę.
Nesustokite dabar... Po reklamos yra daugiau;)
Štai pavyzdys: uranas-235, veikdamas alfa skilimą, sukelia torį. Atkreipkite dėmesį, kad jūsų atominis skaičius sumažėjo tiksliai dviem vienetais (92 - 90 = 2), o jūsų masės skaičius sumažėjo keturiais vienetais (235 - 231 = 4):
92235U → 24α + 90231Th
Atomo ir masės skaičius lieka tie patys pirmame ir antrame šios lygties naryje. Taigi, jei norite sužinoti, kuri dalelė buvo išskirta ar kuris elementas atsirado, tiesiog surašykite šiuos kiekius.
Žvelgdami į periodinę lentelę matome, kad toris yra prieš uraną dvi vietas. Tai akivaizdu, nes cheminiai elementai yra išdėstyti periodinėje lentelėje didėjančia atominio skaičiaus tvarka, o atominis skaičius sumažėjo dviem vienetais:

Torio ir urano elementų vieta periodinėje lentelėje
Tai priveda prie kito apibendrinimo:
Kiekvienas alfa dalelę skleidžiantis atomas tampa elemento atomu dviem vietomis į kairę nuo pradinio elemento.
__________________
* Autorių teisių saugomas vaizdas: podiumuotojas / Shutterstock.com.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. "Pirmasis radioaktyvumo įstatymas arba pirmasis Soddy įstatymas"; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/primeira-lei-radioatividade-ou-primeira-lei-soddy.htm. Žiūrėta 2021 m. Birželio 27 d.