Rūgštys yra medžiagos, kurios jonizuoti vandeninėje terpėje ir yra geri laidininkai galia. Medžiagos rūgštingumą galima išmatuoti naudojant vandenilio jonų potencialo matavimo metodus (pH) sprendimo. Kai kuriuose pH analizės metoduose naudojami tokie indikatoriai kaip lakmusas ar fenolftaleinas, atspindintys spalvos tirpalo pH vertę.
Rūgštys gali būti apibūdinamos:
jo molekulėje yra deguonies arba nėra;
jėga;
jonizuojamais vandeniliais;
savo nepastovumu.
Taip pat skaitykite:Rūgščių ir bazių palyginimas - skirtumai ir savybės
Rūgščių savybės
Jie jonizuojasi vandeninėje terpėje, išskirdami H katijoną+.
Jie yra elektros laidininkai dėl jonai vandeninėje terpėje.
Susilietę su pagrindine aplinka jie kenčia neutralizavimo reakcija, sudarant druską ir vandenį kaip šios reakcijos produktus.
Jie keičia tirpalo spalvą esant indikatorinei medžiagai, tokiai kaip lakmusas ar fenolftaleinas.
Rūgštus citrinos, apelsino, be kitų citrusinių vaisių, skonis yra dėl rūgšties, esančios šiuose maisto produktuose.
Vandenilio potencialas (pH)
Vandenilio jonų potencialas (pH) yra skaičiavimas, išreiškiantis jonų koncentracija vandenilis tam tikroje sprendimas. Norint nustatyti pH ir analizuoti terpę, atsižvelgiama į šiuos dalykus:
Ostwaldo skiedimo dėsnis (kuo labiau praskiestas, tuo daugiau jonų susidarys tirpale);
vandens autoionizacija (Kw), kuris yra natūralus H molekulės skilimas2O H jonuose+ o o-;
distiliuoto vandens 25 ° C temperatūroje autoionizacija yra Kw = 10-14 ir ta pati H jonų koncentracija+ o o-, tai yra, tai yra neutrali terpė.
Skaičiuojant pH su H koncentracija+, naudoti: pH = -log [H+].
Žinau, kad:
pH> 7 → bazinis tirpalas
pH <7 → rūgštus tirpalas
pH = 7 arba pH = pOH → neutralus tirpalas
Taip pat žiūrėkite: Kokie yra rūgščių mišiniai?

Rūgščių klasifikacija
rūgščių klasifikacija galima atlikti atsižvelgiant į keturis skirtingus kriterijus.
Jonizacijos laipsnis (α) arba rūgšties stiprumas
α = jonizuotų molekulių skaičius
ištirpusių molekulių skaičius
Stiprios rūgštys: α ≥ 50%.
Pavyzdys: árūgštis sieros (H2TIK4) → α = 61%.Pusiau stiprios arba vidutinės rūgštys: 5% < α < 50%.
Pavyzdys: fosforo rūgštis (H3Dulkės4) → α = 27%.Silpnos rūgštys: α ≤ 5%.
Pavyzdysboro rūgštis (H3BO3) → α = 0,075%.
→ Jonizuojamo vandenilio skaičius
monorūgštis: išleidžia H katijoną+.
Pavyzdys: árūgštis druskos (HCL);
rūgštis: išleidžia du H katijonus+.
Pavyzdys: vandenilio sulfidas (H2S).Triacidas: išleidžia tris H katijonus+.
Pavyzdysboro rūgštis (H3BO3).tetracidas: išleidžia keturis H katijonus+.
Pavyzdys: pirofosforo rūgštis (H4P2O7).
Dėmesio! Jei tai yra vandenilio rūgštys, visi molekulėje esantys vandeniliai yra jonizuojami; tačiau oksirūgščių atveju jonizuojami yra tik tie vandeniliai, kurie yra prijungti prie deguonies atomo. Pavyzdys yra hipofosforo rūgštis (H3Dulkės2), kuris yra monorūgštis, nes, nepaisant sudėties trijų vandenilių, jis išskiria tik vandenilį, deguonies.
→ Deguonies buvimas
oksirūgštys: turi deguonies struktūrą.
Pavyzdys: hipochlorito rūgštis (HO Cl).
Hidracidai: neturi struktūros deguonies.
Pavyzdys: vandenilio fluorido rūgštis (HF).
→ Nepastovumas
Fiksuotas: virimo taškas(PĖDA) > 100 ° C, lėtai keičiasi į dujinę būseną.
Pavyzdys: sieros rūgštis (H2TIK4) → PE = 340 ° C.lakiųjų medžiagų: virimo temperatūra <100 ° C, greitai ir lengvai keičiasi į dujinę būseną.
Pavyzdys: vandenilio sulfidas (H2S) → PE = -59,6 ° C.
Rūgščių nomenklatūra
→ Hidracidai
Rūgštis + anijono pavadinimas + hidratas
Visoms rūgštims terminas „rūgštis“ vartojamas prieš molekulę apibūdinančią nomenklatūrą. Hidrogenuose elemento pavadinimo priesaga „eto“ pakeičiama į „hidric“.
Pavyzdžiai:
HCl → rūgštis chlorashidraulinis
HBr → rūgštis bromashidraulinis
HF → rūgštis fluorashidraulinis
→ oksirūgštys
Oksirūgščių nomenklatūra skiriasi atsižvelgiant į oksidacijos numeris (NOX) centrinio elemento. Žr. Toliau pateiktą lentelę:
NOX centrinio elemento |
Rūgščių nomenklatūra |
||
priešdėlis- |
-infix- |
-priesaga |
|
+1 ir +2 |
Begemotas |
-aniono pavadinimas- |
-oso |
+3 ir +4 |
-- |
Anijono vardas |
-oso |
+5 ir +6 |
-- |
Anijono vardas |
-ic |
+7 |
Per |
-aniono pavadinimas- |
-ic |
Pavyzdžiai:
HClO → Žinant, kad vandenilis (H) paprastai turi NOX +1, o deguonis (O) - NOX -2, norint turėti 0 krūvio molekulę, chloras (Cl) turi turėti NOX +1, taigi šios rūgšties nomenklatūra yra hipochlorito rūgštis.
HNO2 → azoto rūgštis
HClO4 →árūgštisperchlorinis
→ Taisyklės išimtys
H2CO3 → anglies rūgštis, o ne anglies, kaip tai būtų pagal NOX taisyklę.
H3BO3 → árūgštis boras, o ne nuobodu.
Rūgštys kasdieniame gyvenime
Trąšos ir vaistai: Fosforo rūgštis (H3Dulkės4) yra plačiai naudojamas trąšų gamyboje, taip pat kaip vaistas. Tai yra viena iš kelių rūgščių, naudojamų farmacijos srityje.
Citrusiniai vaisiai: turėti askorbo rūgštį (C.6H8O6), taip pat žinomas kaip Vitamino C.
Actas: turi savo sudėtį Acto rūgštis (CH3COOH).
- Putojantis vanduo ir gaivieji gėrimai: sudarytas iš anglies rūgšties (H2CO3), kuris suteikia produktui gaivų pojūtį.
Taip pat prieiga:Rūgščių vaidmuo gaiviuosiuose gėrimuose

sprendė pratimus
Klausimas 1 - (Enem) Sultys, išgautos iš raudonųjų kopūstų, gali būti naudojamos kaip skirtingų tirpalų rūgšties (pH nuo 0 iki 7) arba bazinės (pH nuo 7 iki 14) požymio. Sumaišius truputį kopūstų sulčių ir tirpalo, mišinys pradeda rodyti skirtingas spalvas pagal rūgštinę ar bazinę prigimtį pagal žemiau pateiktą skalę.
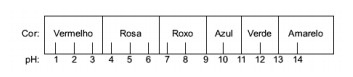
Kai kurie sprendimai buvo išbandyti naudojant šį rodiklį ir davė šiuos rezultatus:
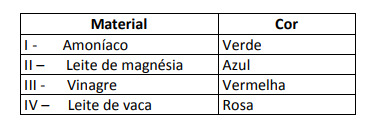
Remiantis šiais rezultatais, I, II, III ir IV sprendimai turi atitinkamai tokį pobūdį:
A) rūgštus / bazinis / bazinis / rūgštus.
B) rūgštis / bazinė / rūgštis / bazinė.
C) bazinis / rūgštus / bazinis / rūgštus.
D) rūgštis / rūgštis / bazinė / bazinė.
E) bazinis / bazinis / rūgštis / rūgštis.
Rezoliucija
E alternatyva. Norint nustatyti, ar medžiaga turi rūgštinę, bazinę ar net neutralią savybę, atliekama bandymo metu gautų spalvų analizė, atsižvelgiant į nurodytos skalės duomenis. Žinodami, kad tirpalai, kurių pH = 7, yra neutralūs, pH> 7 yra baziniai ir pH <7 yra rūgštūs, mes pasiekiame išvada, kad amoniakas ir magnezijos pienas yra pagrindinės medžiagos, o actas ir karvės pienas yra rūgštys.
2 klausimas - (PUC-Camp) Kalbėdamas apie medžiagas, vadinamas rūgštimis, studentas atkreipė dėmesį į šias savybes:
Aš - turiu korozinę galią;
II - sugeba neutralizuoti bazes;
III - susideda iš dviejų cheminių elementų;
IV - sudaro vandeninius tirpalus, kurie praleidžia elektros srovę.
Jis padarė klaidų TIK
A) I ir II
B) I ir III
C) I ir IV
D) II ir III
E) III ir IV
Rezoliucija
B alternatyva. Ne visos rūgštys yra ėsdinančios, tik stipriausios, o rūgštys gali būti sudarytos iš dviejų ar daugiau atomų.
pateikė Laysa Bernardes
Chemijos mokytoja

