Nuo senovės žmogus buvo suinteresuotas atsakyti į klausimą apie materijos sandarą.
Kelios mokslo bendruomenės asmenybės pasisakė šiuo klausimu, tačiau tik XIX amžiaus pabaigoje pradėtos aiškintis paslaptys apie atominę sudėtį.
Pavyzdžiui, senovės filosofas Leucippus manė, kad atomą sudaro mažos dalelės.
Po šio apibrėžimo Demokritas ir Daltonas pasiūlė, kad atominės dalelės būtų masyvios ir nedalomos.
Vėliau šį faktą ginčijo anglų fizikas Thomsonas, kuris atrado elektrono egzistavimą ir sugebėjo patvirtinti anksčiau Leucipo pasiūlytą idėją.
Po šio atradimo Thomsonas pateikė modelį, kuriame atomą suformavo teigiamų krūvių sfera, o branduolio viduje buvo elektronai.
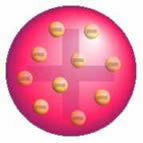
Thomsono atominis modelis - teigiamai įkrautoje, tolygiai paskirstytoje masės sferoje,
jie būtų inkrustuoti neigiamai įkrautais elektronais, kaip pudinge.
Net po Thomsono teorijos atominis modelis vis dar turėjo teorinį-eksperimentinį trūkumą, galintį įrodyti jo teisingumą.
Ši tema buvo dar kartą šiltai aptarta, kai fiziko Rutherfordo komanda pastebėjo, kad buvo labai didelis nuokrypis (ir nepaaiškinama, remiantis razinų pudingo teorija), kai kai kurios radioaktyviosios alfa dalelės prasiskverbė pro ploną laminato sluoksnį metalinis.
Išanalizavęs ir ištyręs faktą, Rutherfordas priėjo prie išvados, kad atomo spindulys yra 10 000 kartų didesnis už branduolio spindulį.
Atlikdamas visą atomo tyrimą, Rutherfordas ir jo komanda 1911 m. Pasiekė atomo modelį, kurį jie pavadino atomo planetiniu modeliu.

1913 m. Nielsas Bohras iššifravo atominį modelį, pritaikydamas savo tyrimams Plancko atrastą veikimo kvantą. Veikimo kvantas iš tikrųjų buvo puikus pakaitos simbolis, kuris užbaigs ir paaiškins atominį modelį.
Bohras efektyviai ir paprastai pakoregavo „Rutherford“ pateiktą modelį ir padarė tokią išvadą:
Elektronas įgyja energiją, kuri vaizduojama per apibrėžtą orbitą. Leistinos orbitos sudaro energijos lygius.

Autorius Talita A. angelai
Baigė fiziką
Brazilijos mokyklos komanda
Fizika Šiuolaikinis - Fizika - Brazilijos mokykla
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm