hidrolizės konstanta (Kh) reiškia a cheminė pusiausvyra nustatyta druskos hidrolizės metu (cheminė reakcija, susijusi su tirpia druska ir vandeniu).
Kaip bet kurios kitos pusiausvyros konstanta, išraiška hidrolizės konstanta yra pagamintas iš produkto koncentracijos sandaugos, padalytos iš reagento koncentracijos sandaugos, taip:
Kh = [Produktai]
[reagentai]
Darbas su hidrolizės konstanta apima žinių apie tris svarbius reiškinius:
- Druskų disociacija;
- Vandens jonizavimas;
- Druskos hidrolizė.
Druskų disociacija
Į vandenį įpylus tirpios druskos, ji disocijuoja ir išskiria kitokį nei hidronio (H +) ir anijono, išskyrus hidroksilą (OH-), katijoną.

Norėdami priminti, kai druska tirpsta ar netirpsta vandenyje, Paspauskite čia ir ištirkite druskos tirpumo lentelę.
vandens jonizacija
Vanduo yra medžiaga, kuri natūraliai išgyvena saviionizacijos reiškinį, tai yra, gamina hidronio katijoną ir hidroksilo anijoną.
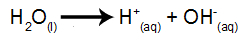
vandens jonizacijos lygtis
druskos hidrolizė
Kaip tirpi druska ji išskiria jonus į vandenį, o vanduo patiria jonizaciją
jonai viduryje gali vykti druskos jonų ir vandens jonų reakcija (hidrolizė). Kai įvyksta ši reakcija, galima sąveika yra:- Druskos katijonas su vandens anijonu (pagrindo susidarymas);
- Druskos anijonas su vandens katijonu (druskos susidarymas);
Pirmiau minėta sąveika atsiras tik tuo atveju, jei susidariusi bazė ar rūgštis yra silpna.
Žr. Druskos hidrolizės pavyzdį:
→ Amonio hipochlorito (NH4ClO) hidrolizė
Į vandenį įpylus amonio hipochlorito, jis ištirpsta ir disocijuojasi, išsiskirdamas amonio katijono jonams (NH4 +) ir hipochlorito anijonui (ClO-):

Lygtis, rodanti jonus, išsiskyrusius amonio hipochlorito disociacijos metu
Kadangi vanduo, veikdamas jonizaciją, gamina H + ir OH-, tirpale turime du katijonus ir du anijonus, kurie gali reaguoti. NH4 + katijonas reaguoja tik su OH- anijonu, nes jis sudaro silpną bazę (NH4OH). ClO-anijonas reaguoja tik su H + katijonu, nes susidaro silpna rūgštis (HClO).

Amonio hipochlorito hidrolizės pusiausvyros lygtis
Hidrolizės konstantos išraiškos konstravimas
Druskos hidrolizės konstantos konstrukcija priklauso tik nuo tos druskos hidrolizės lygties. Pavyzdžiui, amonio hipochlorito hidrolizė, atlikta ankstesniame punkte, sukūrė šią lygtį:

Amonio hipochlorito hidrolizės pusiausvyros lygtis
Kaip sukurti išraišką hidrolizės konstanta atsižvelgiama į produktus ir reagentus, konstantos išraiška būtų:
Kh = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
PASTABA: Vanduo lygtyje nedalyvauja, nes jis yra skystas reagentas, taip pat todėl, kad tai yra pagrindinė priemonė hidrolizei atsirasti, ty yra pastovi.
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
