kampinė geometrija yra vienas iš kelių tipų molekulinė geometrija, kuri vis tiek gali būti linijinė, piramidinė, plokščia trigonė, tetraedrinisir kt. Kampinę geometriją galima rasti tik molekulėse, kurios turi šias charakteristikas:
Triatomika, tai yra, jie turi tik tris atomus;
Centriniame atome turi bent tris elektronų debesis.
Pastaba: elektroninis debesis yra viskas kovalentinis ryšys (viengubas, dvigubas, trigubas arba koordinuotas) tarp atomų ir elektronų porų valentinis sluoksnis kurie nedalyvauja skambutyje.
Peržiūrėkite keletą kampinės geometrijos molekulių pavyzdžių:
1-as pavyzdys: vanduo (H2O)

įprasta vandens struktūra
Vandens struktūroje mes turime:
Trys atomai: du vandeniliai ir vienas deguonis;
Deguonis yra pagrindinis atomas, nes jis sukuria didesnį ryšių skaičių (du, nes priklauso VIA šeimai);
Du vieninteliai ryšiai tarp deguonies ir vandenilio. Taip yra todėl, kad kiekvienas vandenilis gali užmegzti tik vieną, o deguonis - du ryšius;
Keturi nesusiję elektronai deguonyje, nes jo valentiniame apvalkale yra šeši elektronai, o ryšiuose naudojamas tik du.
Todėl, kaip ir vandens molekulėje, centriniame atome yra trys atomai ir keturi elektroniniai debesys (dvi viengubos jungtys ir dvi nesusijungiančios elektronų poros). geometrija yra kampinė.
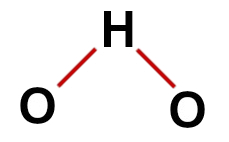
Teisinga vandens struktūrinė formulė
Pastaba: Kai molekulė pateikia šiuos modelius, tarp atomų susidaręs kampas yra maždaug 109 ° 28'.
2-as pavyzdys: Sieros dioksidas (SO2)

Įprasta sieros dioksido struktūra
Sieros dioksido struktūroje mes turime:
Trys atomai: du oksigenai ir vienas sieros atomas;
Siera yra centrinis atomas, nes jis yra mažiausias molekulės elementas, nes visi elementai turi sukurti tą patį ryšių skaičių (du);
Dvigubas ryšys tarp sieros ir vieno iš oksigenų. Taip yra todėl, kad abiem reikia dviejų jungčių;
Vienas koordinatinis arba datinis kovalentinis ryšys, nes po poros su kitu deguonimi siera buvo stabili, tačiau vis tiek yra deguonies atomo, kuriam reikia dviejų elektronų;
Keturi neįpareigojantys elektronai deguonyje. Taip yra todėl, kad deguonies valentiniame apvalkale yra šeši elektronai ir jungtyse naudojamas tik du.
Taigi, kaip ir sieros dioksido molekulėje, centriniame atome yra trys atomai ir keturi elektroniniai debesys (dvi viengubos jungtys ir dvi nesusijungiančių elektronų poros). geometrija yra kampinė.
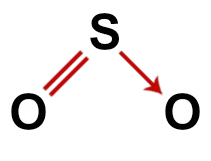
Teisinga sieros dioksido struktūrinė formulė
Pastaba: Kai molekulėje yra šie modeliai, kampas, susidarantis tarp atomų, yra maždaug 120O.
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm

