Sulfoninimo reakcijos alkanuose jie yra organinių pakaitų reakcijos, atliekamas siekiant pagaminti sulfoninės rūgštys (organiniai junginiai, turintys SO grupę)3Prijungtas prie anglies atomo arba prie anglies grandinės) ir vandens (H2O).
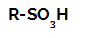
Sulfonrūgšties struktūrinė formulė
Už sulfoninimo reakcijos vykdymą alkanai, turime sumaišyti alkaną (junginį, kurį sudaro anglies grandinė, prisotinta tik anglies ir vandenilio atomais) ir sieros rūgšties (H2TIK4) koncentruotas, kaitinamas (∆).
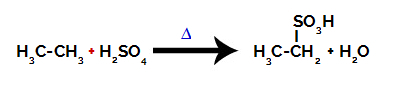
Cheminė lygtis, apibūdinanti dviejų anglies alkanų sulfoninimą
Alkanų sulfoninimo reakcijos principai
Toks kaip alkano sulfoninimo reakcija tai yra pakaitinė reakcija, joje vyksta mainai tarp mažesnių komponentų elektronegatyvumas reagentų, tai yra tarp alkano ir sieros rūgšties. Alkanas turi vandenilį ir sieros rūgštį - sulfoninę grupę.
Žemiau mes turime žingsnis po žingsnio a mechanizmą sulfoninimo reakcija alkanuose. Kaip pavyzdį naudosime paprasčiausią alkaną - metaną (CH4):
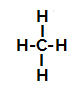
Struktūrinė metano formulė
1-as žingsnis: Suardymas tarp hidroksilo (OH) ir sieros (S) sieros rūgštyje.
Kiekviena sieros rūgštyje esanti hidroksilo grupė pasižymi tuo, kad yra labiau elektronegatyvi. Kaitinant reakcijos metu, linkimas tarp hidroksilo grupės ir sieros nutrūksta:
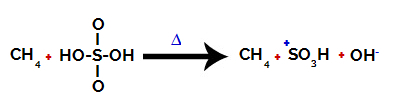
Sieros ir hidroksilo jungties sutrikimas
Visų hidroksilų jungtis nenutrūksta dėl elektroninio pertvarkymo struktūroje. Tada gaunamas hidroksido anijonas (OH).-) ir sulfoninis katijonas.
2 žingsnis: Hidroksilo grupės ataka prieš alkano molekulę.
Tada hidroksi grupė (OH-) atakuoja alkaną, todėl nutrūksta anglies ir vandenilio jungtis (kuri yra silpnesnė dėl jų tarpusavio elektronegatyvumo skirtumų).
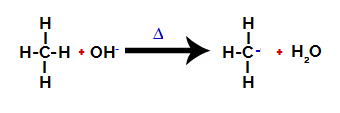
Nutraukiant anglies ir vandenilio ryšį alkane
Pastaba: Anglies ir vandenilio ryšys visada nutrūks, kai anglis yra mažesnio elektroninio tankio ar krūvio. Kuo mažiau anglies vandenilio yra ar kuo daugiau grupių yra, tuo mažesnis jos elektronų tankis. Taigi mes turime:
Tretinė anglis
Nutraukus ryšį, alkanas tampa anglies trūkumo elektronu (karbokacija). Hidroksido grupė (OH)-) sąveikauja su išsiskyrusiu vandeniliu ir suformuoja vandens molekulę.
3 žingsnis: Susidariusio radikalo ataka ant sulfoninės grupės.
Galiausiai sulfono grupę užpuola likęs alkanas ir susidaro sulfono rūgštis.
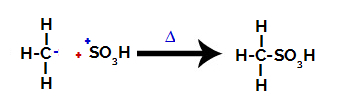
Struktūros, kurios sąveikauja ir sudaro sulfono rūgštį
Lygčių, vaizduojančių sulfaninimo reakcijas alkanuose, pavyzdžiai
1-as pavyzdys: Propano sulfoninimas.
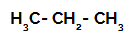
Propano struktūrinė formulė
Propane yra du pirminiai angliai ir viena antrinė anglis, kurie turi skirtingus krūvius, nes yra surišti su skirtingu vandenilio kiekiu. Kadangi anglis yra labiau elektronegatyvi nei vandenilis, šie angliai turi skirtingą elektronų tankį.
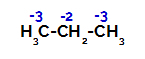
Kiekvieno propano anglies atomo krūvių pasiskirstymas
Ant pirminių anglies krūvis yra -3 (nes jis sujungtas su trimis vandeniliais), o ant antrinės anglies - -2 (nes jis sujungtas su dviem vandeniliais). Taigi nutrūks jungtis tarp anglies ir vandenilio, kartais prie anglies 1 (vienos molekulės), kartais prie anglies 2 (kitos molekulės).
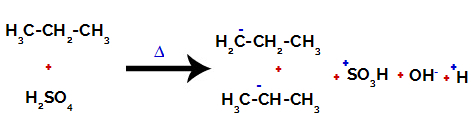
Nutraukiant anglies ir vandenilio ryšį ant skirtingų anglies junginių
Po pertraukų tarp jungčių, esančių sieros rūgštyje ir alkane, susidaro produktai pakeičiant vandenilį anglies 1 sulfonine grupe, ir tas pats vyksta ir anglyje 2.
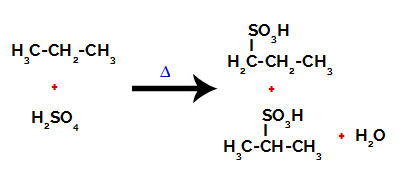
Produktai, susidarantys sulfoninant propaną
2-as pavyzdys: 2-metilbutano sulfoninimas.

2-metil-butano struktūrinė formulė
2-metil-butane yra trys pirminiai angliai, antrinė anglis ir tretinė anglis skirtingi krūviai ir atitinkamai skirtingi elektroniniai tankiai, kaip matyti iš šios struktūros:
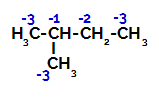
Elektroninių krūvių paskirstymas 2-metilbutane
Todėl 2-metil-butane yra keletas galimybių nutraukti ryšį tarp anglies ir vandenilio, kuris gali atsirasti dėl anglies 1 (molekulės), anglies 2 (kitos molekulės), anglies 3 arba anglies 4. Tačiau pažymėtina, kad 2-ojo anglies kiekio sutrikimai yra dažnesni.
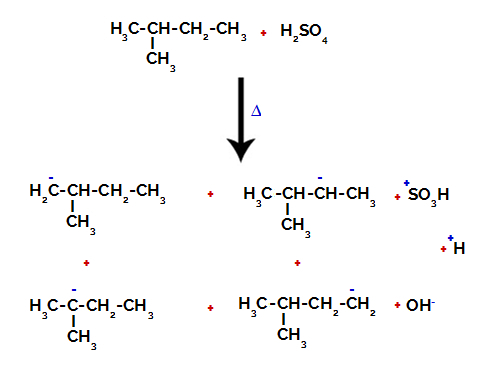
Nutraukiant anglies ir vandenilio ryšį ant skirtingų anglies junginių
Suskaidžius jungtis tiek sieros rūgštyje, tiek alkane, susidaro produktai pakeičiant vandenilį anglies 1 sulfonine grupe, ir tas pats atsitinka ir anglis 2.

Produktai, susidarantys sulfoninant 2-metilbutaną
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
