Viduje konors papildymo reakcijosį alkenai(angliavandeniliai, turintys dvigubą jungtį tarp dviejų anglies atomų), pi ryšys tarp dviejų anglių yra nutrūkęs ir kiekvienas anglies jungiasi prie naujo atomo. Pažvelk:
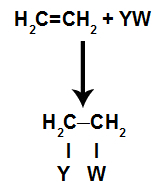
Bendras scheminis papildymo reakcijos modelis
Papildymo reakcijos principai
a) pi jungties lūžimas
Pi ryšys lengvai nutrūksta, nes jis yra silpnesnis nei sigmos ryšys. Tačiau, kad tai įvyktų, būtina, kad alkenas būtų veikiamas tokiomis trikdžių sąlygomis. Pertraukus pi ryšį tarp dviejų anglių, ant kiekvieno dalyvaujančio anglies visada atsiranda jungimosi vieta (naujiems atomams).
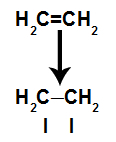
Scheminė schema, vaizduojanti pi jungties lūžimą
b) Pi jungties nutraukimo sąlygos
Veiksniai, kurie palaiko pi obligacijos nutraukimą, yra šie:
Katalizatorių naudojimas;
Šildymas;
Rūgštis yra reakcijos terpėje.
c) Papildymo reakcijos atsiradimas
Susijungimo vietas, susidariusias nutrūkus pi jungčiai, visada užims to reagento atomai, kuris yra tame pačiame inde kaip ir alkenas. Papildymo reakcija pavadinta pagal reagento, sumaišyto su alkenu, tipą.
Priedų reakcijų tipai alkenuose
a) Hidrinimas
Alkenas sumaišomas su vandenilio dujomis (H2) inde ir veikiamas kieto katalizatoriaus (nikelio, platinos ar paladžio) ir kaitinamas (Δ).
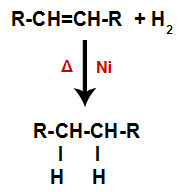
Bendra hidrinimo reakcijos alkenuose schema
Katalizatoriaus buvimas ir kaitinimas sukelia alkeno pi ryšį ir sigma ryšį tarp H vandenilių2 greičiau sulaužyti. Tai sukurdami dvi jungimosi vietas alkene ir du laisvuosius vandenilio atomus reakcijos terpėje.

Atomų rišimosi ir atskyrimo vietų sukūrimas
Taigi iškart po to kiekvienas laisvas vandenilio atomas užima vieną iš alkene susidariusių jungimosi vietų. Kadangi susidariusi medžiaga turi tik anglis ir vandenilius, taip pat tarp anglies turi tik paprastus ryšius, tai yra a alkanas.
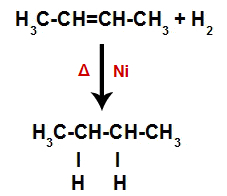
Lygtis, vaizduojanti alkano susidarymą hidrinant
B) Halogeninimas
Alkenas sumaišomas su paprastomis medžiagomis (F2, Cl2, br2 Ei2) suformuotas halogenai (chloras, fluoras, jodas ir bromas) inde ir veikiami šviesos (λ) ir kaitinimo (Δ).

Bendra halogeninimo reakcijos alkenuose schema
Dėl šviesos ir kaitinimo alkeno pi ryšys ir sigmos ryšys tarp halogeno sudarytų medžiagų greičiau nutrūksta. Tai sukūrę dvi jungimosi vietas alkene ir du laisvuosius halogeno atomus reakcijos terpėje.

Atomų rišimosi ir atskyrimo vietų sukūrimas
Taigi iškart po to kiekvienas laisvas halogeno atomas užima vieną iš alkene susidariusių jungimosi vietų. Kadangi susidariusi medžiaga turi halogeną, susietą su struktūra, susidedančia iš anglies ir vandenilio, tai yra a organinis halogenidas.

Lygtis, vaizduojanti organinių halogenidų susidarymą halogeninant
c) Hidratacija
Alkenas sumaišomas su vandeniu (H2O) inde ir veikiamas katalizatoriaus (šiuo atveju sieros rūgšties).
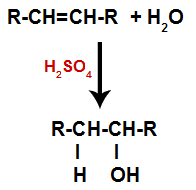
Bendra hidratacijos reakcijos alkenuose schema
Sieros rūgšties buvimas reakcijoje priverčia alkeno pi ryšį ir sigmos ryšį tarp vandenilio (H) ir vandens hidroksilo (OH) greičiau suirti. Tokiu būdu mes sukuriame dvi rišimosi vietas alkene ir laisvą vandenilį bei hidroksilą reakcijos terpėje.
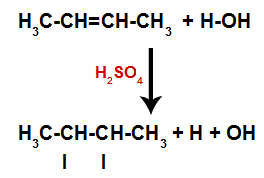
Atomų rišimosi ir atskyrimo vietų sukūrimas
Taigi netrukus po to vandenilis ir hidroksilas užima vieną iš alkene susidariusių jungimosi vietų. Kadangi susidariusi medžiaga turi hidroksilą, susijungusį su sočiąja anglimi (ji tik užmezga paprastus ryšius), tai yra alkoholis.
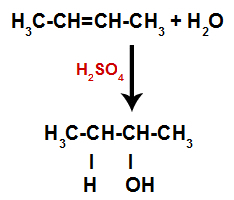
Lygtis, vaizduojanti alkoholio susidarymą drėkinant
d) Papildymas vandenilio halogenidais
Alkenas maišomas su halogeninta neorganine rūgštimi (HF, HI, HCl, HBr) inde.

Rūgščių halogenidų reakcijos alkenuose schema
Rūgštyje esant rūgščiai, alkeno pi jungtis greičiau nutrūksta. Rūgštyje sutrinka vienintelis ryšys, nes šios medžiagos natūraliai jonizuojasi. Taigi alkene susidaro dvi jungimosi vietos ir reakcijos terpėje yra laisvo vandenilio ir halogeno.
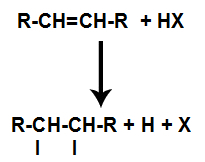
Atomų rišimosi ir atskyrimo vietų sukūrimas
Taigi netrukus po to vandenilis ir halogenas užima vieną iš alkene susidariusių jungimosi vietų. Kadangi susidariusi medžiaga turi halogeną, susietą su struktūra, susidedančia iš anglies ir vandenilio, tai yra organinis halogenidas.
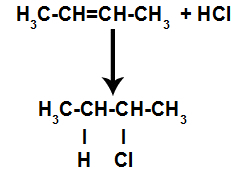
Lygtis, vaizduojanti organinių halogenidų susidarymą halogeninant
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm
