Bazė yra neorganinė medžiaga kuri, pasak švedų chemiko Svante Arrhenius, įdėtas į vandenį, kenčia nuo reiškinio joninis atsiribojimas, kuriame yra jonai: katijonas (Y+) ir hidroksido anijonas (OH-).

Arrhenius bazės bendroji formulė
a grupė Y bazė tai gali būti bet kuris metalas arba amonio grupės metodas (NH4+), kurie disociacijos metu išsiskiria vandenyje kaip katijonai, kaip matyti iš procesą apibūdinančios lygties:
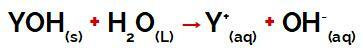
Lygtis, vaizduojanti bazės disociaciją
Toliau pateikiama labai svarbi informacija apie ES klasifikaciją ir nomenklatūrą pagrindai.
1) Klasifikacija pagal bazių tirpumas(gebėjimas kad ištirptų vandenyje)
Pagrindai tirpus: sudėtis turi šarminį metalą arba amonį;
Pagrindai mažai tirpus: turi šarminis žemės metalas kompozicijoje. Pavyzdys: magnio hidroksidas, plačiai naudojamas kaip antacidinis ir vidurius laisvinantis vaistas;
pagrindai praktiškai netirpus: kompozicijoje turi bet kurį kitą metalą. Pavyzdys: aliuminio hidroksidas, plačiai naudojamas kaip antacidas.
2) Klasifikacija pagal pagrindinė jėga(gebėjimas atsiriboti vandenyje)
Pagrindai stiprusSudėtyje yra šarminių arba šarminių žemės metalų, išskyrus magnį;
Pagrindai silpnas: kompozicijoje turi bet kurį kitą metalą.
3) Pagrindinė nomenklatūra
Norėdami pavadinti bazę, tiesiog vadovaukitės toliau pateikta pavadinimo taisykle:
Hidroksidas + de + metalo arba amonio pavadinimas
Pavyzdys: Ca (OH)2 → kalcio hidroksidas
Jei bazėje yra cheminių elementų, nepriklausančių IA, IIA ar IIIA šeimoms (ir tai nėra sidabro ar cinko), prieš elemento pavadinimą, romėniškais skaitmenimis, turime nurodyti skaičių hidroksilai:
Pavyzdys: Ti (OH)4 → titano hidroksidas IV
Mano. Diogo Lopes
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm

