A elektrosfera yra atomo sritis, kurioje elektronus Jie yra įsikūrę. Elektrosfera, tiksliau, susideda iš atominių orbitalių, nustatytų sprendžiant Šriodingerio lygtį. Pirmą kartą pagal Rutherfordo modelį nustatyta, kad Bohro atominio modelio galiojimo metu elektrosfera patyrė didelę pažangą.
Elektrosfera gali būti suskirstyta į sluoksnius (arba energijos lygius), nes elektronai turi apibrėžtą (nenuolatinę) energiją. Atomams, turintiems du ar daugiau elektronų, apvalkalai dalijasi į subapvalus (arba subapvalus). Elektrosfera yra nepaprastai svarbi norint suprasti atomo savybes ir suprasti cheminių ryšių susidarymą.
Taip pat skaitykite: Kaip suskaidomas atomas?
Santrauka apie elektrosferą
Elektrosfera yra atomo sritis, kurioje yra elektronai.
Jį sudaro atominės orbitos, bangų funkcijos, kurios yra Schrödingerio lygčių sprendimai.
Jo koncepcija prasidėjo nuo Ernesto Rutherfordo modelio.
Elektronai laikomi elektrosferoje dėl jų traukos prie atomo branduolio.
Pagrindiniai pasiekimai suprantant elektrosferą įvyko Nielso Bohro modelio koncepcijos metu.
Jį sudaro sluoksniai (arba energijos lygiai), kurie yra apibrėžtos energijos regionai.
Atomų, turinčių daugiau nei vieną elektroną, apvalkalai dalijasi į posluoksnius (arba subapvalus).
Elektrosfera yra svarbi norint suprasti keletą savybių, tokių kaip atominis panašumas, stabilumas, atominis spindulys, jonizacijos energija, elektronų afinitetas, be to, suprasti ryšių susidarymą chemikalai.
Video pamoka apie elektrosferą
Kas yra elektrosfera?
Elektrosfera apibrėžiama kaip atominės struktūros sritis, kurioje yra elektronai. Išsamesniuose aiškinimuose sakome, kad jį sudaro atominės orbitos, bangos funkcijos, kurios yra Schrödingerio lygties sprendimai. Matematinė atominės orbitalės išraiška, pabrėžta kvadratu, parodo elektrono vietos tam tikrame taške tikimybės tankį.
O Elektrosferos samprata pradėjo atsirasti kartu su Ernesto Rutherfordo atominis modelis, kuriame yra elektronai, skriejantys aplink tankų teigiamą branduolį. Vėliau Nielsas Bohras pateikė reikšmingesnių elektrosferos interpretacijų, maišydamas kvantinės mechanikos sąvokas.
Elektrosferos sluoksniai
Elektronai laikomi elektrosferoje dėl jų traukos prie atomo branduolio. Tačiau žinoma, kad šios elektronai yra apvalkaluose, kurių energija yra gerai apibrėžta. Tokie sluoksniai taip pat gali būti vadinami energijos lygiais.
Tokia išvada padaryta po spektroskopijos eksperimentų. Pavyzdžiui, kai elektros srovė yra tiekiama dujoms H2 Esant žemam slėgiui, šviesą skleidžia H2. Šioje būsenoje susidaro H jonai+ ir elektronų, kurie grįš į H jonus+ ir sudarys sužadintas (suaktyvintas) H rūšis+. Norėdami pašalinti energijos perteklių, H jonai+ išskiria energiją elektromagnetinės spinduliuotės (šviesos) pavidalu ir rekombinuoja į H dujas2 vėl.
Galbūt prisiminsite, kad kai balta šviesa praeina per prizmę, ji suskaidoma į ištisinį spektrą (panašiai kaip vaivorykštė); tačiau tas pats neįvyksta su šviesa, sklindančia iš H2: kai tokia spinduliuotė praeina per prizmę, H emisijos spektre pastebimos tik ryškios linijos su apibrėžtu bangos ilgiu2, žinomas kaip spektrinės linijos.
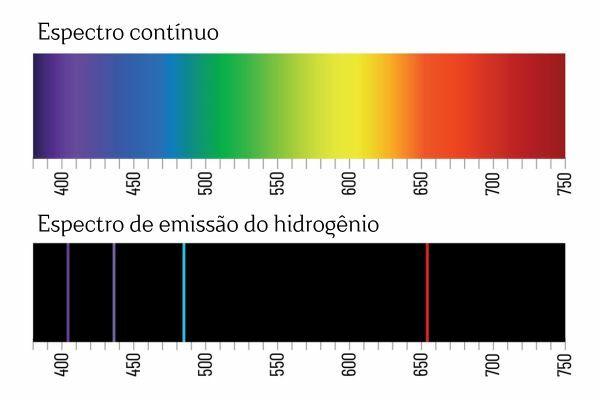
Elementų emisijos spektrų (su aiškiai apibrėžtomis spektro linijomis) aiškinimas yra toks: elektronas, atome, negali pateikti jokios energijos, veikiau tiksliai apibrėžtais kiekiais (vadinamieji energijos paketai). Jei elektronai neturėtų tokių energetinių apribojimų, elementų emisijos spektras būtų ištisinis, kaip ir baltos šviesos, einančios per prizmę.
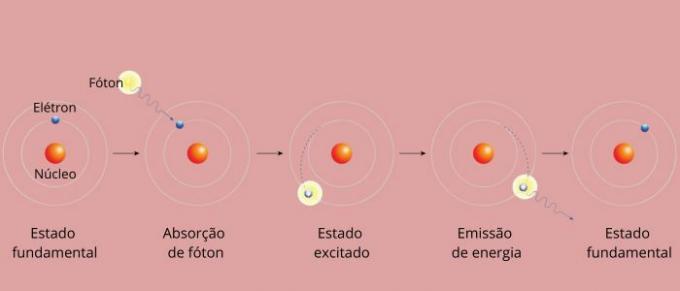
Kiekviena elemento spektrinė linija tapo žinoma kaip energijos lygis. (arba sluoksnis, kaip mes labiau įpratę sakyti). Šios linijos atsiranda, kai elektronas pereina iš vieno leistino energijos lygio į kitą energijos kaitos procese, vadinamame elektroniniu perėjimu.
Elektroninio perėjimo metu elektronas pereina iš žemesnio energijos lygio į aukštesnį energijos lygį. Grįžęs į pradinį lygį, per elektromagnetinę spinduliuotę (šviesą) skleidžia energijos perteklių, duodamas pradžios nuo spektrinės linijos, kurios spinduliuojama energijos vertė yra proporcinga vertei, apibrėžtai lygtimi Rydbergas.
Johannesas Rydbergas buvo švedų spektroskopuotojas, sukūręs lygtį spektrinių linijų tendencijai apibrėžti, remdamasis šveicarų profesoriaus Johano Balmerio darbais. Kiekvieno sluoksnio savitoji energija apibrėžiama sprendžiant atitinkamą Schrödingerio lygtį.
Kiekviename elektroniniame sluoksnyje yra leistinas elektronų skaičius. Šiuo metu yra apibrėžti septyni elektroniniai sluoksniai, žymimi raidėmis K iki Q abėcėlės tvarka arba raide n, kur n ≥ 1. Taigi, sluoksnis K yra sluoksnis, kuriame n = 1 ir pan. Leidžiamas elektronų skaičius viename apvalkale parodytas šioje lentelėje.
Energijos lygis |
Sluoksnis |
Maksimalus elektronų skaičius |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
O |
32 |
6 |
P |
18 |
7 |
K |
8 |
Hidrogenoidiniams atomams (su tik 1 elektronu, pvz., H, He+, Li2+), visos atominės orbitalės turi vienodą energiją (vadiname jas išsigimusiomis orbitomis); tačiau atomuose, kuriuose yra du ar daugiau elektronų, atsiranda labai svarbus efektas – elektronų-elektronų atstūmimas. Šio fakto pasekmė yra ta, kad kiekvieno sluoksnio orbitalės pradeda turėti skirtingą energiją, todėl sluoksniai pradedami apibūdinti kaip posluoksniai (arba polygiai).
Dabartiniams atomams kiekvienas sluoksnis gali būti suskaidytas į keturis polygius, žymimas raidėmis „s“ (iš anglų kalbos, aštrus), „p“ (iš anglų k., pagrindinis), „d“ (iš anglų k., difuzinis) ir „f“ (iš anglų k., esminis).
Kiekvienas polygis palaiko maksimalų elektronų skaičių, apibrėžtą skaičiavimais ir eksperimentais. „s“ polygis palaiko iki 2 elektronų; „p“ polygis, iki 6 elektronų; „d“ polygis, iki 10 elektronų; ir „f“ polygis – iki 14 elektronų. K sluoksnis yra vienintelis, leidžiantis tik vieną orbitą, todėl turi tik vieną polygį.
Energijos lygis |
Sluoksnis |
Polygiai |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
N |
4s, 4p, 4d, 4f |
5 |
O |
5s, 5p, 5d, 5f |
6 |
P |
6s, 6p, 6d |
7 |
K |
7s, 7p |
Elektrosferos funkcija
Kiekvieno atomo elektrosfera gali būti panaudotas įvairioms atomo savybėms ir elgesiui paaiškinti.
Tokios savybės kaip atominis spindulys, joninis spindulys, jonizacijos energija ir elektronų afinitetas turi vertes, kurios yra tiesioginės elektrosferos elektroninės konfigūracijos pasekmė. vadinamas valentiniu apvalkalu, kuris iš tikrųjų yra atokiausias elektroninis atomo ar jono apvalkalas.
A Tos pačios grupės atomų panašumas periodinėje lentelėje taip pat yra elektroninės konfigūracijos pasekmė valentinio apvalkalo. Cheminiuose procesuose mes pasirenkame atomus iš tos pačios periodinės lentelės grupės pakaitalai, ir tai tik tikėtina, nes šie atomai turi tą pačią elektroninę konfigūraciją sluoksnyje valentingumo.
Į cheminiai ryšiai, kurie atsiranda tarp atomų, sudarydami joninius ir kovalentinius junginius (molekules), taip pat atsiranda sąveikaujant tarp atomų elektrosferų.
Taip pat skaitykite: Schrödingerio atominis modelis – būdas apibūdinti atomą naudojant kvantinę mechaniką
Elektrosferos ir atominės struktūros ryšys
Kaip minėta, elektrosfera apima atomo sritį, kurioje galima rasti elektronų. Tiksliau tariant, elektronai yra atominėse orbitose, kurių energija yra apibrėžta kvantiniais skaičiavimais.
Elektrosfera yra didžiausia atominės struktūros sritis, nes atomo branduolys yra labai mažas. Galvojant apie atomą kaip apie futbolo stadioną, branduolys atitiktų kamuolį aikštės centre, o likusi stadiono dalis būtų elektrosfera.
Nepaisant to, pagal masę elektrosfera prisideda mažai. Kadangi elektronų masė yra apie 1836 kartus mažesnė nei protonų ir neutronų, galime teigti, kad beveik visa atomo masė yra sutelkta branduolyje.
Išsprendė elektrosferos pratimus
Klausimas 1
(Facisb 2023) Bohro vandenilio atomo modelyje elektronas gali užimti tik tam tikras orbitas. Kai kurios iš šių orbitų pavaizduotos paveikslėlyje, kur n reiškia energijos lygius, kuriuos elektronas turi kiekvienoje orbitoje.
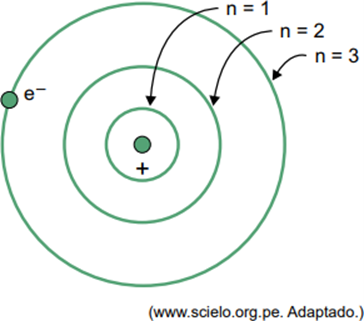
Apsvarstykite, kad vandenilio atome elektronas yra orbitoje, kur n = 5.
Pagal Bohro modelį šis elektronas išskirs energiją elektromagnetinės spinduliuotės pavidalu tik tada, kai
(A) pereikite prie orbitos, kurioje n yra lygus 6.
(B) lieka orbitoje, kur n = 5.
(C) perėjimas į bet kurią orbitą, kurioje n yra didesnis nei 5.
(D) perėjimas į bet kurią orbitą, kurioje n yra mažesnis nei 5.
(E) yra išmetamas iš atomo, jonizuojantis jį.
Atsakymas: D raidė
Kai elektronas yra išoriniame apvalkale, grįžęs į vidinį apvalkalą su mažesne energija, jis išskiria energijos perteklių elektromagnetinės spinduliuotės (šviesos) pavidalu. Todėl šviesa atsiras tik tada, kai elektronas, esantis n = 5, pereis į vidinį apvalkalą.
2 klausimas
(Uerj 2019) Neseniai mokslininkams pavyko pagaminti metalinį vandenilį suspaudžiant molekulinį vandenilį esant aukštam slėgiui. Šio elemento metalinės savybės yra tokios pačios kaip ir kitų periodinės klasifikacijos lentelės 1 grupės elementų.
Šis panašumas yra susijęs su energingiausiu šių elementų po lygiu, kuris atitinka:
(A) ns1
(B) n.p.2
(C) ne3
(D) nf4
Atsakymas: A raidė
Vandenilio atomas turi tik vieną elektroną, esantį pirmame lygyje, polygyje „s“ (1s1). Viena iš priežasčių, kodėl jis randamas periodinės lentelės 1 grupėje, yra ta, kad visi kiti šios grupės cheminiai elementai turi atomus, kurių valentinis apvalkalas yra to paties tipo (ns1). Todėl dėl panašaus valentinio sluoksnio vandenilis galėjo būti gaminamas tokiu metaliniu pavidalu.
Šaltiniai:
DO CANTTO, E. L.; LEITA, L. L. W.; CANTO, L. W. Chemija – kasdienybėje. 1. red. San Paulas: Moderna, 2021 m.
ATKINS, P.; JONES, L.; LAVERMANAS, L. Chemijos principai: kvestionuoti gyvybę ir aplinką. 7. red. Porto Alegrė: „Bookman“, 2018 m.
ATKINS, P.; DE PAULA, J.; KEELER, J. Atkinso fizinė chemija. 11 leid. Oksfordas: Oxford University Press, 2018 m.
