Vienas papildymo reakcija yra cheminis procesas, kurio metu neorganinės medžiagos atomai pridedami prie organinės molekulės, kuri turi turėti vieną iš šių savybių:
Atvira struktūra, kurioje yra rišiklis arba pi nuorodos;
Sotoji uždara struktūra (tik su sigmos nuorodos);
Uždara nesočioji struktūra (su pi arba aromatiniu ryšiu).
Organiniai junginiai, turintys šias charakteristikas, yra tokie Angliavandeniliai:
alkenai;
Alkynes;
Alkadienai;
Dviračiai;
Dviračiai;
Aromatika.
Per a papildymo reakcija, vienas ar keli pi ryšiai arba sigmos ryšys (išskyrus ciklano atvejus) yra nutrūkę sukeldami du ar daugiau laisvų valentų (jungimosi vietų) ant susijusių anglių, kaip pavyzdyje žemyn:
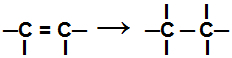
Pertrauka alkeno jungties
Po to, kai ši jungtis nutrūksta, organuose turi būti sukurta naujų atomų. Žemiau pateikiame tipus papildymo reakcijos kad galima atlikti naudojant organinius junginius.
hidrinimas
Šiame papildymo reakcija, be organinio junginio, kitas reagentas yra vandenilio dujos (H2). Kiekviename anglyje, kuriame vyksta skilimas (nutrūkus sigmos ar pi jungtims, kaip buvo matyti anksčiau), bus vandenilio atomo ryšys, nurodantis suskaidytų ryšių kiekį.
Pavyzdžiui, kai atliekame ciklobutano hidrinimą, tarp 1 ir 2 anglies sutrinka sigmos ryšys. Tada vandenilio atomas prisijungia prie kiekvieno iš šių anglių:
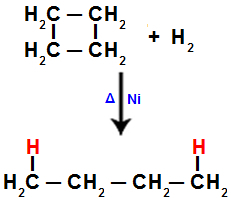
Hidrinimo ciklobutane lygtis
Halogeninimas
Be organinio junginio, kitas reagentas papildymo reakcija yra molekulinis halogenas (chloro-Cl dujos2, fluoro-F dujos2, kietasis jodas-I2 ir skystas bromas-Br2). Prie kiekvienos anglies, kur vyksta skilimas (sigmos arba pi jungties nutrūkimas, kaip matyti aukščiau), bus atomo jungtis. halogenas nurodant nutrūkusių jungčių skaičių.
Taigi, kai atliekame ciklopropeno halogeninimą (naudojant chloro dujas), pi jungtis nutrūksta tarp 1 ir 2 anglies. Tada prie kiekvieno iš šių anglies jungiasi chloro atomas:

Halogeninimo ciklopropene lygtis
Papildymo reakcija su halogenidu
Halogenidas yra neorganinė vandenilio rūgštis, kurią sudaro vandenilio atomas ir vandenilio atomas. halogenas, pvz., druskos rūgštis (HCl), vandenilio fluorido rūgštis (HF), bromo vandenilio rūgštis (HBr), rūgštis hidrojodinis (HI).
At papildymo reakcija su halogenidu, be organinio junginio, kitas reagentas yra halogenidas, taigi vienas iš anglies atomų, kur dalijimasis (sigmos ar pi jungties nutrūkimas, kaip matyti aukščiau), turi gauti vandenilio atomą, o kitas - halogenidas.
Pagal Markovnikovo valdžia, labiausiai hidrintas anglies atomas (arba anglis, prijungta prie mažesnio radikalo) turi gauti vandenilis, o mažiau hidrinti anglis (arba anglis, prisijungusi prie didesnio radikalo) turi gauti halogenidas.
Pavyzdžiui, kai mes atliekame šią reakciją su propenu su druskos rūgštimi (HCl), pi jungtis nutrūksta tarp 1 ir 2 anglies. Tada vandenilis prisijungia prie anglies 1 (labiau hidrinto), o chloras - prie anglies 2 (mažiau hidrinto):
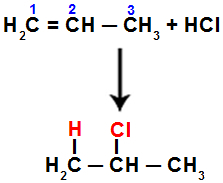
Lygtis, vaizduojanti propeno pridėjimą su halogenidu
Hidratacijos reakcija
Vandens molekulė, jonizuodama, gamina hidronio katijoną (H+) ir hidroksido anijoną (OH-). Dėl šios priežasties papildymo reakcija, be organinio junginio, kitas reagentas yra vanduo. Taigi vienas anglies junginys, kuriame vyksta skilimas (nutrūkus sigmos ar pi jungčiai, kaip matyti aukščiau), gauna hidronio katijoną, o kitas - hidroksido anijoną.
Pagal Markovnikovo taisyklę labiausiai hidrinamas anglies atomas (arba anglis, prisijungusi prie mažesnio radikalo) turi gauti hidronį, o mažiau hidrinti anglis (arba anglis, prisijungusi prie didesnio radikalo) - hidroksidas.
Pavyzdžiui, kai hidratuojame penta-1,4 dieną, pi jungtis nutrūksta tarp 1 ir 2 anglies ir 4 ir 5 anglies. Tada angliai 1 ir 5 gauna hidronį, o 2 ir 4 angliavandeniai - hidroksidą:
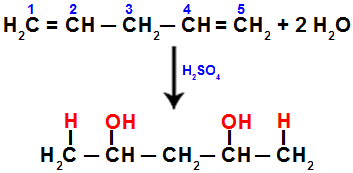
Lygtis, vaizduojanti sudėjimą su hidratacija penta-1,4 diene
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-reacao-adicao.htm


