Hibridizacijos teorija atsirado kaip papildymas Aštuoneto teorija, sugebėdamas paaiškinti didesnio skaičiaus molekulių, įskaitant boro suformuotas molekules, struktūrą (B).
Šiame elemente yra penki įžemintos būsenos elektronai su tokia elektronine konfigūracija:
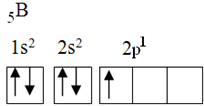
Pagal okteto teoriją boras galėjo užmegzti tik vieną kovalentinį ryšį, nes jis turi tik vieną nepilną atominę orbitą. Tačiau eksperimentiškai pažymima, kad šis elementas sudaro junginius, kuriuose jis atlieka daugiau nei vieną ryšį.
Pavyzdys yra boro trifluoridas (BF3). Kaip parodyta žemiau, boras sukuria tris kovalentinius ryšius su fluoru, pasidalindamas trimis poromis elektronų ir paskutiniame apvalkale (valentiniame sluoksnyje) yra šeši elektronai, ty išimtis oktetas.
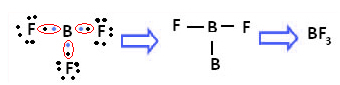
Tai paaiškinama hibridizacijos reiškiniu, kuris įvyksta su boru. Pasirodo, kad 2 pakopos elektronas sugeria energiją ir patenka į sužadintą būseną, kurioje jis peršoka į tuščią 2p pakopos orbitą. Tokiu būdu susidaro trys nepilnos orbitos, kurios dabar gali užmegzti tris kovalentinius ryšius:
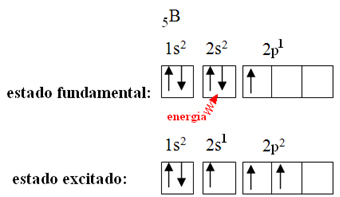
Tačiau boro trifluoride susidariusios jungtys yra vienodos, tačiau jei pažvelgsime aukščiau, yra dvi jungtys skiriasi, nes vienas iš jų būtų padarytas s orbita, o kiti du - tokio tipo orbita. tipas p. Čia vyksta hibridizacija, tai yra, neužbaigtos orbitos susilieja ir atsiranda trys hibridinės orbitos arba hibridizuotas, kurie yra identiški ir skiriasi nuo originalų:
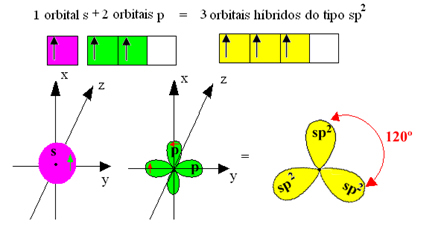
Kadangi šios hibridinės orbitos susideda iš vienos s orbitos ir dviejų p orbitalių, ši hibridizacija vadinama sp² hibridizacija.
Prie boro jungiantis fluoras turi devynis elektronus. Elektroninis platinimas ir orbitos parodytos žemiau:
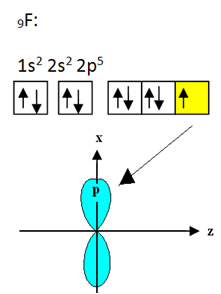
Atkreipkite dėmesį, kad kiekvienas fluoro atomas gali užmegzti tik vieną kovalentinį ryšį ir kad šią jungtį jungianti orbita yra p tipo. Taigi, žemiau stebėkite, kaip formuojasi orbitos, darant jungtis, kurios sudaro BF3 ir pažiūrėkite, kaip nuorodos yra identiškos σp-sp2:
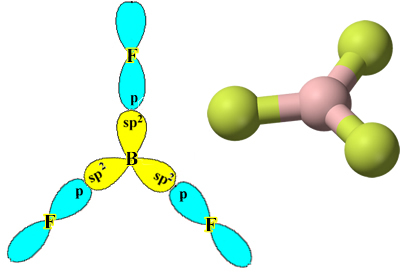
Tai atsitinka ir su kitais elementais, žr., Pavyzdžiui, tekstą „Berilio hibridizacija”.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm
