Daugelyje automobilių naudojamas kuras yra benzinas ir etanolis. Visiškai deginant šiuos du degalus susidaro anglies dioksidas (CO2 g)) ir vandens (H2O). Deja, neužbaigtas degimas ir alkoholyje bei benzine esančios priemaišos gali sukelti aplinką labai teršiančias medžiagas. Benzino atveju anglies monoksidas (COg)); angliavandeniliai (junginiai, susidedantys iš anglies ir vandenilio), tokie kaip etanas (C.2H6 g)); ir azoto oksidai (NOx), daugiausia azoto monoksidas (NO) ir azoto dioksidas (NO2 g)).
Taigi, norint išvengti oro taršos padidėjimo, visiems automobiliams reikia vadinamos įrangos katalizinis arba katalizinis konverteris, kuris yra taršą mažinantis įtaisas, kurio funkcija yra apdoroti šias vidaus degimo variklio išskiriamas dujas ir paversti jas mažiau kenksmingomis dujomis. Tam tikruose pramonės procesuose kataliziniai konverteriai taip pat naudojami.
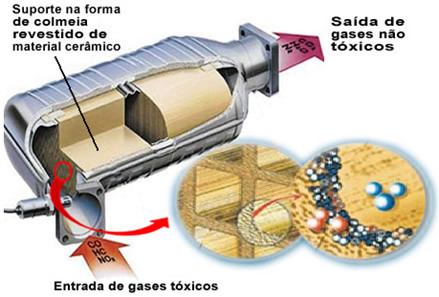
Minėtos teršalų dujos palieka variklį ir patenka į katalizatorių, eidamos per tam tikrą „avilį“, kurių ląstelės paprastai yra pagamintos iš keramikos ar metalo medžiagos, padengtos aliuminio oksidu (aliuminio oksidu - Al
2O3). Ši korio forma su mažais kanalais yra svarbi, nes ji suteikia didelį dujų kontaktinį paviršių, todėl jos greičiau reaguoja.Tačiau tikrasis katalizatorius yra metalas, sėdintis ant aliuminio oksido. Paprastai naudojami metalai yra paladis, rodis, platina arba molibdenas. Taip pat galite sumaišyti šiuos metalus ir naudoti lydinius. Pavyzdžiui, benzino atveju paprastai naudojamas paladžio ir torio lydinys; etanolio atveju naudojamas kitas paladžio ir molibdeno lydinys. Šie metalai vykdo heterogeninę katalizę su teršiančiomis dujomis.
heterogeninė katalizė tai yra reakcijos tipas, kai katalizatorius su reagentais (šiuo atveju - teršiančiomis dujomis) susidaro polifazinė sistema. Taip yra todėl, kad katalizatorius adsorbuojasi, tai yra, jis išlaiko reagentų molekules ant savo paviršiaus, susilpnindamas jų ryšius ir paspartindamas reakcijos procesą.
Dėl to katalizatoriai metalai transformuoja teršalus, tokius kaip CO ir NOx netoksiškose dujose, tokiose kaip CO2, H2O, O2 ir ne2. Žiūrėkite keletą šių reakcijų žemiau ir atkreipkite dėmesį, kad per jas vyksta angliavandenilių oksidacija ir CO (gaunamas ne iki galo deginant) ir azoto oksidus paverčiant azoto dujomis (N2):
2 COg) + 2 NEg) → 2 CO2 g) + 1 N2 g)
2 COg) + 1 O2 g) → 2 CO2 g)
2C2H6 g) + 7 O2 g) → 4 CO2 g) + 6 H2Ov)
2 NE2 g) +4 COg) → 1 N2 g) + 4 CO2 g)
2 NE2 g) → 1 N2 g) + 2 O2 g)
2 NEg) → 1 N2 g) + 1 O2 g)
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm

