Vienas buferinis tirpalas tai mišinys, naudojamas užkirsti kelią terpės pH ar pOH pokyčiams, kai pridedama stiprių rūgščių ar stiprių bazių.
Yra dviejų tipų buferiniai tirpalai:
1. Silpnos rūgšties mišinys su konjuguota baze;
2. Silpnos bazės mišinys su konjuguota rūgštimi.
Pažvelkime į kiekvieno pavyzdį ir kaip jie veikia, kai į terpę pridedamas nedidelis kiekis stiprios rūgšties ar bazės:
1. Silpnos rūgšties ir konjuguotos bazės mišinys:
Kad susidarytų toks tirpalas, silpna rūgštis sumaišoma su to paties anijono druska kaip ir rūgštis.
Pavyzdžiui, apsvarstykite buferinį tirpalą, sudarytą iš acto rūgšties (H3COCOOH(čia)) ir natrio acetatas (H3COCOONas). Pažiūrėkite, ar abu turi acetato anijoną: (H3CCOO-(čia)). Šių jonų koncentraciją praktiškai lemia druskos disociacija, kuri yra didelė. Rūgščių jonizacija yra maža.

Dabar atkreipkite dėmesį į tai, kas vyksta šiomis papildomomis galimybėmis:
- Nedidelis kiekis stiprios rūgšties:
Pridedant stiprios rūgšties, padidėja hidronio jono H koncentracija3O+1
ir kadangi acto rūgštis yra silpna rūgštis, acetato anijonas turi didelį afinitetą protonui (H+) hidronio. Tokiu būdu jie reaguoja ir susidaro daugiau acto rūgšties:
Dėl to terpės pH praktiškai nesikeičia. Tačiau jei pridedama vis daugiau stiprios rūgšties, ateis laikas, kai bus sunaudotas visas acetato anijonas ir buferinis poveikis nebebus.
- Pridėti nedidelį kiekį stiprios bazės:
Pridedant stiprią bazę, padidėja OH jonų koncentracija-. Bet šiuos jonus neutralizuoja H jonai3O+1 išsiskiria acto rūgšties jonizacijos metu:

Su šia reakcija susidaro H jonų koncentracija3O+1(čia) sumažės ir bus pusiausvyros poslinkis didinant rūgšties jonizaciją, todėl tirpalo pH kitimas bus labai mažas. H jonų koncentracija3O+1(čia) jis bus praktiškai pastovus.
Šiuo atveju taip pat yra ribinis buferio pajėgumas. Todėl, jei pridėsime vis daugiau bazės, rūgšties jonizacijos balansas vis labiau pasislinks jos jonizacijos link, kol bus sunaudota visa rūgštis.
2. Silpnos bazės mišinys su konjuguota rūgštimi:
Šio tipo buferinis tirpalas susideda iš silpnos bazės ir druskos tirpalo, kuriame yra tas pats katijonas kaip ir pagrinde.
Pavyzdžiui, apsvarstykite buferinį tirpalą, kurį sudaro magnio hidroksidas, MgOH2 (aq) (silpna bazė) ir magnio chloridas, MgCl2 (s) (druska). Abiejuose yra magnio katijono (Mg2+(čia)). Terpėje esantys magnio jonai praktiškai gaunami dėl druskos disociacijos, nes bazės disociacija yra silpna:
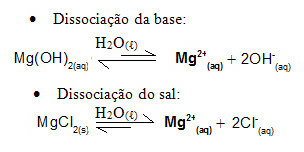
- Nedidelis kiekis stiprios rūgšties:
Šiuo atveju H jonai3O+1 pridėjus stiprios rūgšties, neutralizuos OH jonai-, atsirandantis dėl silpnos bazės atsiribojimo. Tai pakeis pagrindinę disociacijos pusiausvyrą į dešinę.
Taigi, pH kitimas (jei toks yra) bus labai mažas, nes OH jonų koncentracija- išlieka pastovus. Buferinis efektas nebeliks, kai atsiribos visa bazė.
- Pridėti nedidelį kiekį stiprios bazės:
Pridėtoje stiprioje bazėje vyksta disociacija, išskiriant OH jonus-. Kadangi magnio hidroksidas yra silpna bazė, magnis, išsiskyręs atsiribojęs nuo druskos, turės didesnę tendenciją reaguoti su OH-:

Todėl OH jonų padidėjimas- kompensuoja proporcingas Mg (OH) padidėjimas2 (aq). Dėl to pH didelių pokyčių nevyksta.
Šis poveikis baigiasi, kai sunaudojamas visas magnio katijonas.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm

