Jei būtų įmanoma labai aiškiai vizualizuoti metalo struktūrą, tai matytume kaip aukščiau esančiame paveikslėlyje. Metalų atominė struktūra yra kristalinė, kurią sudaro metalų katijonai, apsupti elektronų.
Metaluose esančios kristalinės grotelės gali būti pavaizduotos taip: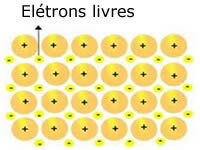
Metalo natrio (Na) atvaizdavimas
Metalų kristalines groteles sudaro fiksuotų katijonų grupė.
Kiekvieną Na + katijoną supa elektronai, tačiau jie yra delokalizuoti, tai yra, jų netraukia nė vienas branduolys.
Kadangi tarp neigiamų krūvių (elektronų) ir teigiamų branduolių (katijonų) nėra traukos, laisvieji elektronai galiausiai užima visą metalinę kristalinę gardelę. Elektronų judėjimo laisvė priverčia juos suformuoti elektroninį debesį.
Metalų gebėjimas praleisti elektrą paaiškinamas šio debesies buvimu. Elektros srovė atsiranda dėl laisvųjų elektronų sąlyčio su kitais metalais.
Bet kurio atomo, įskaitant metalus, tokius kaip natris (Na), auksas Au, varis (Cu), sudėtyje yra valentinis sluoksnis. Elektronai laisvai juda per šį sluoksnį, išlaikydami elektromagnetinę trauką katijonams. Ši struktūrinė savybė leidžia susidaryti metalinėms molekulėms, taigi ir patiems metalams.
Autorius Líria Alves
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm