Kovalentinis ryšys atsiranda, kai du atomai dalijasi elektronų poromis, kad gautų elektronų konfigūraciją tauriosios dujos (su 8 elektronais valentiniame apvalkale arba su 2, jei yra tik K apvalkalas), pagal taisyklę oktetas.
Tačiau yra ypatingų kovalentinių ryšių atvejų, kai bendra elektronų pora ateina tik iš vieno iš atomų, kuris jau yra stabilus. Anksčiau šis kovalentinio ryšio tipas buvo vadinamas datinis, šiandien jis dažniau vadinamas koordinuoti.
Peržiūrėkite keletą pavyzdžių, kad suprastumėte, kaip tai vyksta:
- CO (anglies monoksidas):
Anglies valentiniame apvalkale yra 4 elektronai. Todėl pagal okteto taisyklę, norint būti stabiliu, reikia gauti dar 4 elektronus, iš viso 8. Kita vertus, deguonies valentiniame apvalkale yra 6 elektronai, todėl norint gauti tauriųjų dujų neono konfigūraciją, reikia gauti 2 elektronus.
Taigi, pirma, anglis ir deguonis dalijasi dviem elektronų poromis, kad deguonis būtų stabilus:
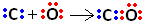
Tačiau anglis išlieka nestabili, nes ji vis dar turi 6 elektronus ir jai reikia 2. Todėl deguonis, kuris jau yra stabilus, dalijasi viena iš savo elektronų porų su anglimi, tai yra, jis užmezga datinį ryšį, todėl stabilus:

Atkreipkite dėmesį, kad koordinačių kovalentinis ryšys gali būti pavaizduotas brūkšneliu, kaip ir įprastas kovalentinis ryšys.
- TIK2 (Sieros dioksidas):
Kiekvieno sieros ir deguonies atomo valentiniuose apvalkaluose yra 6 elektronai, todėl jiems reikia gauti po 2 elektronus. Iš pradžių siera užmezga dvi bendras kovalentines jungtis, pasidalindama dviem elektronų poromis su vienu iš deguonies atomų, kurie abu išlieka stabilūs su 8 elektronais.
Bet kitas deguonies atomas nėra stabilus, todėl siera dalijasi elektronų pora su juo per koordinuotą arba datinį kovalentinį ryšį:
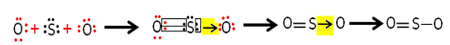
Atkreipkite dėmesį, kad šiuo atveju molekulėje yra trys atomai, todėl gali būti jungties migracija iš vieno atomo į kitą. Sieros dioksido molekulę taip pat galima pavaizduoti taip: O ─ S ═ O.
Mes vadiname šį klijavimo reiškinį rezonansas. Toliau pateiktoje lentelėje žr. Dar tris pavyzdžius:
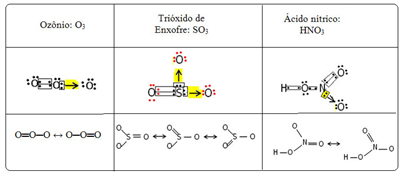
Vadinamos galimos struktūros rezonanso struktūros arba kanoninės formos.
Šio tipo jungtis taip pat atsiranda formuojantis jonams, kaip ir hidronio jonams (H3O+) ir amonio (NH4+).
Pirma, H katijonas+ jis susidaro, kai vandenilis praranda vienintelį elektroną, palikdamas teigiamą krūvį. Taigi, norint būti stabiliu, reikės priimti du elektronus. Tai atsitinka per datinį ryšį su vandeniu (hidronio jono atveju) ir su amoniaku (amonio jono atveju). Žiūrėti:

Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm
