Į periodinės lentelės šeimos yra vertikalios lentelės sekos ir surinkti cheminiai elementai su panašiomis cheminėmis savybėmis. Tokie panašumai atsiranda dėl to, kad elementams, sugrupuotiems į tą pačią šeimą, yra vienodas valentinių elektronų kiekis. Šeimos reprezentacinius elementus talpina 1 ir 2 grupėse, nuo 13 iki 18, o pereinamuosius elementus – 1–12 grupėse.
Taip pat skaitykite:Transuraniniai elementai – žmogaus sukurti cheminiai elementai, atsirandantys po urano periodinėje lentelėje
Šio straipsnio temos
- 1 – Periodinių lentelių šeimų suvestinė
- 2 - Periodinių lentelių šeimų organizavimas
-
3 – Periodinių lentelių šeimų nomenklatūra
- → Reprezentatyvūs periodinės lentelės elementai
- → Periodinės lentelės perėjimo elementai
- 4 – Periodinių lentelių šeimų cheminiai elementai
-
5 – Pagrindinės periodinės lentelės šeimų charakteristikos
- → 1 grupė arba šarminių metalų šeima
- → 2 grupė arba šarminių žemių metalų šeima
- → 3–12 grupės arba pereinamųjų metalų šeima
- → 13 grupė arba boro šeima
- → 14 grupė arba anglies šeima
- → 15 grupė arba azoto šeima
- → 16 grupė arba deguonies šeima (kalkogenai)
- → 17 grupė arba halogenų šeima
- → 18 grupė arba inertinių dujų šeima
-
6 - Periodinė lentelė ir elektroninis platinimas
- → Elektroninis reprezentacinių elementų platinimas
- → Elektroninis pereinamųjų elementų paskirstymas
- 7 - Išspręstos pratybos apie periodinės lentelės šeimas
Periodinių lentelių šeimų suvestinė
Šeimos atitinka vertikalias linijas Periodinė elementų lentelė.
Taip pat žinomos kaip grupės, šeimos periodinėje lentelėje yra sunumeruotos nuo 1 iki 18.
Tos pačios šeimos cheminiai elementai turi panašias chemines savybes.
Elementų rinkinio žinomumas paaiškinamas tuo, kad turi vienodą valentinių elektronų skaičių.
Reprezentaciniai elementai skirstomi į 1, 2, 13, 14, 15, 16, 17 ir 18 grupes. Kiekviena iš šių šeimų turi specifinius pavadinimus.
Pereinamieji elementai sudaro vieną šeimą, kuri suskirstyta į 3, 4, 5, 6, 7, 8, 9, 10, 11 ir 12 grupes.
Nesustok dabar... Po viešumos dar daugiau ;)
Periodinių lentelių šeimų organizavimas
Šeimos periodinėje lentelėje yra vertikalios lentelės sekos, tai yra, stulpeliai. Taip pat žinomos kaip grupės, periodinės lentelės šeimos yra sunumeruoti nuo 1 iki 18, iš kairės į dešinę.
Cheminiai elementai, užimantys tą pačią kolonėlę, laikomi priklausančiais tai pačiai šeimai., dėl jų cheminių savybių panašumo, kuris atsiranda dėl to, kad jie turi tą patį skaičių elektronų adresu valentinis apvalkalas. Pavyzdžiui, visi 18 šeimos cheminiai elementai valentiniame apvalkale (visame apvalkale) turi aštuonis elektronus ir retai dalyvauja cheminiai ryšiai.
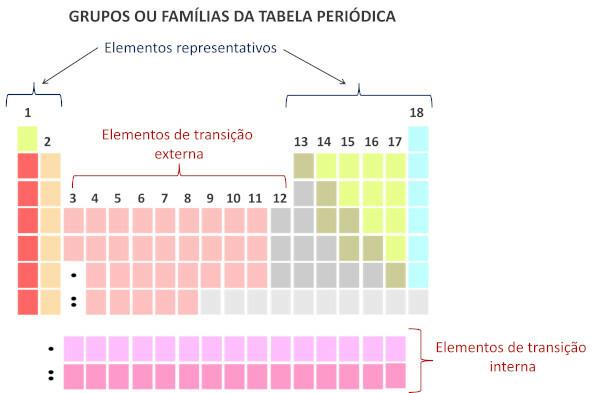
Pagal šiuolaikinę sistemą Tarptautinė grynosios ir taikomosios chemijos sąjunga (Iupac), kiekviena grupė ar šeima periodinėje lentelėje identifikuojama skaičiumi nuo 1 iki 18, pradedant iš kairės į dešinę.
Svarbu pabrėžti, kad senoji IUPAC sistema priėmė raidinę ir skaitmeninę sistemą, o raidės A ir B atitinkamai nurodo reprezentacinius ir pereinamuosius elementus. Šiuo metu tokio tipo nomenklatūra nebenaudojama.
Periodinių lentelių šeimų nomenklatūra
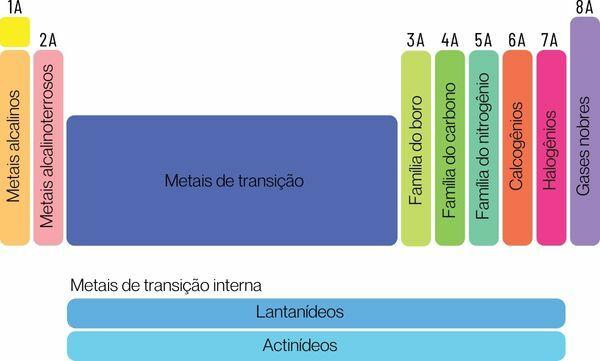
Cheminius elementus galima suskirstyti į dvi dideles šeimas: reprezentacinius elementus ir pereinamuosius elementus.
→ Reprezentatyvūs periodinės lentelės elementai
Reprezentaciniai elementai skirstomi į 1, 2, 13, 14, 15, 16, 17 ir 18 grupes. Kiekviena iš šių grupių turi konkretų pavadinimą, kuriuo ji taip pat gali būti žinoma. Žiūrėk:
1 grupė: šeima metalai šarminis.
2 grupė: šeima šarminių žemių metalų.
13 grupė: boro arba žemės metalų šeima.
14 grupė: anglies šeima.
15 grupė: Azoto arba Pnikogenų šeima.
16 grupė: deguonies arba kalkogeno šeima.
17 grupė: šeima halogenai.
18 grupė: šeima tauriųjų dujų.
→ Periodinės lentelės perėjimo elementai
Tu pereinamieji elementaisudaryti vieną šeimą, suskirstytą į 3, 4, 5, 6, 7, 8, 9, 10, 11 ir 12 grupes.. Lantanido ir aktinidų serijos taip pat yra pereinamųjų elementų dalis.
Perėjimo elementai visi yra metaliniai ir turi panašias chemines savybes, net ir turėdami skirtingus elektronus valentiniame apvalkale, todėl sudarytų vieną ir didelę pereinamųjų metalų šeimą.
Cheminiai elementai iš periodinės lentelės šeimų
Kiekviena šeima ar grupė susideda iš cheminių elementų rinkinio. Žr. kiekvienos šeimos cheminių elementų aprašymą:
1 grupė:ličio, natrio, kalio, rubidis, cezis, francium.
2 grupė:berilio, magnio, kalcio, stroncio, baris, radijas.
3 grupė:skandis, itris, lantanido serija ir aktinidų serija.
4 grupė: titano, cirkonisO, hafnis tai yra rutherfordiumas.
5 grupė:vanadis, niobis, tantalas tai yra dubnium.
6 grupė:chromo, molibdenas, volframas tai yra Seaborgium.
7 grupė:mangano, technecijus, renis tai yra bohrio.
8 grupė: geležies, rutenis, osmis tai yra hassium.
9 grupė:kobalto, rodis, iridis ir meitneris.
10 grupė:nikelio, paladis, platina ir darmstadtio.
11 grupė: vario, sidabras, auksas ir rentgeno.
12 grupė:cinko, kadmis, Merkurijus ir Kopernikas.
13 grupė: boro, aliuminio, galio, indis ir talis.
14 grupė: anglies, silicio, germanis, skarda, vadovauti ir fleroviumas.
15 grupė:azoto, fosforo, arseno, stibis tai yra bismutas.
16 grupė:deguonies, sieros, seleno, telūro, polonis ir livermoris.
17 grupė: fluoras, chloro, bromas, jodo ir astatinas.
18 grupė:helis, neoninis, argonas, kriptonas, ksenonas tai yra radonas.
Svarbu: cheminis elementas vandenilis yra ypatingas atvejis, nes nepaisant to, kad jis yra šalia 1 grupės, jis nepriklauso šarminių metalų šeimai, nes neturi panašių cheminių savybių.
Žinoti daugiau: Kokie yra radioaktyvieji elementai periodinėje lentelėje?
Pagrindinės periodinės lentelės šeimų charakteristikos
Jie yra metaliniai, blizgūs ir lygūs.
Jie turi aukštą šilumos laidumą ir aukštą Elektros laidumas.
turėti temperatūros santykinai žemo lydymosi.
Jie labai reaguoja su vandens.
Tendencija formuotis vienavalečiams katijonams (įkrovimas +1).
Jie yra kietos metalinės medžiagos, blizgios ir kietesnės, palyginti su šarminiais metalais.
Jie lengvai oksiduojasi.
Jie pasižymi dideliu šilumos laidumu ir dideliu elektros laidumu.
Jų lydymosi temperatūra yra šiek tiek aukštesnė nei šarminių metalų.
Jie reaguoja su vandeniu.
Polinkis formuotis dvivalečiams katijonams (įkrovimas +2).
Jie yra didžiausia šeima periodinėje lentelėje.
Kietos, blizgios metalinės medžiagos.
Jie pasižymi dideliu šilumos laidumu ir dideliu elektros laidumu.
Tankus.
Aukšta lydymosi temperatūra.
gali pasirodyti skirtingai oksidacijos būsenos.
→ 13 grupė arba boro šeima
Jie turi tarpines savybes tarp metalų savybių ir ne metalai.
Aplinkos sąlygomis jie yra kieti.
Polinkis formuotis trivalečiams katijonams (įkrovimas +3).
→ 14 grupė arba anglies šeima
Jie turi tarpinių savybių tarp metalų ir nemetalų savybių.
Aplinkos sąlygomis jie yra kieti.
Tendencija formuoti keturis ryšius.
Aplinkos sąlygomis jie yra kieti.
Anglis ir silicis gali sudaryti grandininius ryšius.
→ 15 grupė arba azoto šeima
Jie turi tarpinių savybių tarp metalų ir nemetalų savybių.
Kietosios medžiagos aplinkos sąlygomis, išskyrus azotą, kuris yra dujos.
Azotas ir fosforas yra pagrindiniai gyvų organizmų elementai.
Arsenas yra labai toksiškas.
→ 16 grupė arba deguonies šeima (kalkogenai)
Jie turi skirtingas savybes, keičiasi nuo nemetalinio iki metalinio elemento, kai pereinate į šeimą.
Kietosios medžiagos aplinkos sąlygomis, išskyrus deguonį, kuris yra dujos.
Polinkis formuotis dvivalenčių anijonų (krūvis -2).
→ 17 grupė arba halogenų šeima
Jie yra nemetalai.
Gana reaktyvus.
Blogi šilumos ir elektros laidininkai.
Aplinkos sąlygomis fluoras ir chloras egzistuoja kaip dujų, bromas yra skystas, o jodas – kietas.
Polinkis formuotis monovalentiniams anijonams (krūvis -1).
→ 18 grupė arba inertinių dujų šeima
Jie yra nemetalai.
Labai mažai reaguoja, todėl jas galima vadinti inertinėmis dujomis.
Jie egzistuoja dujų pavidalu.
Jie neturi polinkio formuotis jonų.
Periodinė lentelė ir elektroninis platinimas
Tai pačiai šeimai ar grupei priklausantys cheminiai elementai turi panašias chemines savybes, nes turi vienodas elektronų skaičius valentiniame apvalkale.
Elektronų skaičius valentingame apvalkale yra svarbus, nes nuo jo priklauso katijonų susidarymo ar anijonai, susidarančio cheminio ryšio tipas, cheminėse reakcijose dalyvaujanti energija ir kt charakteristikos. Norėdami sužinoti valentinių elektronų skaičių, būtina žinoti atominis skaičius elemento ir atlikite savo elektroninis platinimas.
→ Elektroninis reprezentacinių elementų platinimas
Reprezentatyvūs elementai turi energingiausius elektronus polygiuose s tai yra P elektroninio sluoksnio (n). Šioje lentelėje pateikiamos elektroninės konfigūracijos, susijusios su kiekviena reprezentacinių elementų šeima. terminas n svyruoja nuo 1 iki 7 ir reiškia valentinių elektronų užimtą energijos lygį, atitinkantį periodinės lentelės, kurioje randamas elementas, periodui (horizontaliajai linijai).
Elektroninis reprezentacinių elementų platinimas | ||
šeima ar grupė |
Elektroninis platinimas |
Pavyzdys |
1 |
mus1 |
Li (Z=3): 1 sek2 2s1 |
2 |
mus2 |
Būti (Z=4): 1 sek2 2s2 |
13 |
mus2 np1 |
B (Z=5): 1 sek2 2s22p1 |
14 |
mus2 np2 |
C (Z=6): 1 s2 2s22p2 |
15 |
mus2 np3 |
N (Z=7): 1 s2 2s22p3 |
16 |
mus2 np4 |
O (Z=8): 1 sek2 2s22p4 |
17 |
mus2 np5 |
F (Z=9): 1 s2 2s22p5 |
18 |
mus2 np6 |
Ne (Z=10): 1 sek2 2s22p6 |
→ Elektroninis pereinamųjų elementų paskirstymas
Pereinamieji elementai yra paskirstyti tarp 3 ir 12 grupių ir turėti polygius d tai yra f užima valentiniai elektronai:
Išoriniai perėjimo elementai: išlaikyti valentinius elektronus polygyje d, išlaikant elektronų konfigūraciją lygią mus2 (n-1)d(nuo 1 iki 8). Pavyzdžiui, elementas nikelis (Z = 28) priklauso 10 grupei, o jo konfigūracija yra 1s.2 2s2 2p6 3s2 3p6 4s2 3d8.
Vidiniai perėjimo elementai: jie yra 3 grupės dalis, bet yra periodinės lentelės „vidiniai“ ir yra išplėsti žemiau jos 6 (lantanidai) ir 7 (aktinidai) periodais. Šie elementai turi valentinius elektronus, užimančius subapvalką f ir bendra elektroninė konfigūracija mus2 (n-2)f(nuo 1 iki 13). Pavyzdžiui, elementas lantanas (Z = 57) yra pirmasis elementas lantanido serijoje, o jo elektronų konfigūracija yra 1 s.2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Taip pat žinokite:Kokia yra periodinės lentelės kilmė?
Išsprendė pratimus apie periodinės lentelės šeimas
Klausimas 1
(UFC – pritaikyta) Kalbant apie šiuolaikinę periodinę elementų klasifikaciją, pažymėkite tikrąjį teiginį:
A) Periodinėje lentelėje šeimos arba grupės atitinka horizontalias linijas.
B) Šeimos elementai turi labai skirtingas chemines savybes.
C) Šeimoje elementų paskutiniame apvalkale paprastai yra tiek pat elektronų.
D) Tam tikru laikotarpiu elementai turi panašias chemines savybes.
E) Reprezentatyvūs elementai skirstomi į 3–12 grupes.
Rezoliucija:
Alternatyva C
A punktas yra neteisingas: šeimos arba grupės yra periodinės lentelės stulpeliai (vertikalios linijos).
B ir D punktai neteisingi: šeimoje elementai turi panašias chemines savybes. Laikotarpiais elementai turi tą patį elektronų apvalkalą, kurį užima valentiniai elektronai.
C punktas teisingas: šeimoje elementų paskutiniame apvalkale yra tiek pat elektronų.
E punktas neteisingas: reprezentaciniai elementai yra 1, 2, 13, 14, 15, 16, 17 ir 18 grupės. Pereinamieji elementai skirstomi į 3–12 grupes.
2 klausimas
(EAM) Elementai A, B ir C turi šias elektronų konfigūracijas savo valentiniuose apvalkaluose:
A: 3s1
B: 4s2 4p4
C: 3s2
Remdamiesi šia informacija, pasirinkite tinkamą parinktį.
A) Elementas A yra šarminis metalas.
B) Elementas B yra halogenas.
C) Elementas C yra chalkogenas.
D) Elementai A ir B priklauso trečiajam periodinės lentelės periodui.
E) Trys elementai priklauso tai pačiai periodinės lentelės grupei.
Rezoliucija:
Alternatyva A
A punktas teisingas: elementas A turi elektroninį skirstinį, kuriame yra tik vienas valentinis elektronas, todėl jis priklauso periodinės lentelės 1 grupei.
Neteisingas B elementas: elementas B turi 4s elektronų konfigūraciją2 4p4, rodantis, kad paskutiniame apvalkale yra 6 elektronai ir kad šis elementas priklauso 16 grupei (kalkogenai).
Neteisingas C punktas: elementas C turi elektroninę konfigūraciją su 2 elektronais paskutiniame apvalkale, todėl lentelėje jis yra 2 grupės elementas.
Neteisingas elementas D: elementas A priklauso trečiajam periodui (n = 3), o elementas B priklauso ketvirtajam periodui (n = 4).
Neteisingas E punktas: trys elementai turi skirtingą elektronų kiekį paskutiniame apvalkale, todėl jie negali būti tos pačios šeimos dalis.
Ana Luiza Lorenzen Lima
Chemijos mokytojas
Spustelėkite čia, sužinokite, kas yra valentinis sluoksnis, ir sužinokite, kaip jį atpažinti.
Supraskite, kaip vykdomas elektroninis platinimas, ir peržiūrėkite pavyzdžius.
Sužinokite apie vidinių pereinamųjų elementų (aktinidų ir lantanidų), kurie užima šeštąjį ir septintąjį periodinės lentelės 3 grupės periodus, ypatumus.
Žinokite esamus cheminius elementus, supraskite, kas jie yra ir kaip juos pavaizduoti.
Tauriosios dujos yra vieninteliai gamtoje izoliuoti elementai. Sužinokite daugiau apie juos šiame straipsnyje!
Sužinokite apie halogenus, jų savybes, charakteristikas ir pagrindinį naudojimą kasdieniame gyvenime.
Sužinokite daugiau apie šarminių žemės metalų savybes, savybes ir pritaikymą.
Supraskite, kas yra atominis skaičius, ir sužinokite, kokias atomo savybes galima nustatyti pagal jį.
Patikrinkite čia, kas yra periodinė lentelė, ir peržiūrėkite interaktyvų modelį, kad sužinotumėte visus ją sudarančius cheminius elementus.


