O Schrödingerio atominis modelis yra įprasta forma, naudojama apibūdinti atomo aprašymas sprendžiant Šriodingerio lygtį, kurią 1927 m. pasiūlė austrų fizikas Erwinas Schrödingeris. Lygtis sumanyta remiantis svarbiais kvantinės mechanikos stebėjimais, suteikiančiais tvirtą atomo ir elektrono energijos pagrindimą.
Schrödingerio sukurtas atomas yra pagrįstas bangų ir dalelių dvilypumu, neapibrėžtumo principu, be kitų sąvokų, sukurtų XX amžiaus pradžioje. Tai padarė didelę pažangą materijos supratimui, nes atvėrė kelią tvirtesniam polielektroninių atomų supratimui, o tai neįmanoma naudojant Bohro pasiūlytą atominį modelį.
Taip pat skaitykite: Atominiai modeliai – modeliai, pasiūlyti paaiškinti atomo struktūrą
Šio straipsnio temos
- 1 – Schrödingerio atominio modelio santrauka
- 2 – Kas yra Schrödingerio atominis modelis?
-
3 – Šriodingerio atominio modelio eksperimentinis pagrindas
- Fotoelektrinis efektas
- bangos-dalelės dvilypumas
- neapibrėžtumo principas
- 4 – Šriodingerio atominio modelio charakteristikos
- 5 – Schrödingerio atominio modelio pažanga, palyginti su kitais atominiais modeliais
Santrauka apie Schrödingerio atominį modelį
Schrödingerio atominis modelis iš tikrųjų yra atomo ir elektronų aprašymas per Schrödingerio lygtį.
Schrödingerio lygtis buvo sukurta atliekant svarbius kvantinės mechanikos tyrimus.
Bangos ir dalelių dvilypumas, neapibrėžtumo principas, be kitų teorijų, buvo esminiai Šriodingerio lygties sukūrimui.
Išsprendus Šriodingerio lygtį, galima apibūdinti tiek atomo, tiek elektrono energiją.
Remiantis Schrödingerio lygties aiškinimu, galima pastebėti, kad elektronai neturi apibrėžta orbita aplink atomą, o greičiau egzistavimo tikimybės aplinka sritis nuo jo.
Schrödingerio studijos išplečia Bohro pasiūlyto atomo supratimas, nes jie leidžia suprasti polielektroninių atomų elgesį.
Kas yra Schrödingerio atominis modelis?
Schrödingerio atominis modelis yra įprastas pavadinimas atominio modelio, paremto kvantine mechanika, aprašymas. Pagrindinė šio modelio savybė yra matematinė bangų ir dalelių dvilypumo interpretacija, kurią perima elektronai, daugiau konkrečiai, tiksliai apibrėžtos elektrono trajektorijos pakeitimas elektrono egzistavimo aplink jį tikimybe. šerdis.
Toks aiškinimas prasidėjo austrų mokslininko Erwino Schrödingerio darbu, 1927 m., po svarbių pasiekimų. suprasti medžiagą kvantinės mechanikos srityje, pavyzdžiui, fotoelektrinį efektą, neapibrėžtumo principą ir dvilypumą bangos dalelė.
Schrödingerio atominio modelio supratimas nėra trivialus, į jį kreipiamasi aukštesniuose chemijos studijų lygiuose.
Nesustok dabar... Po viešumos dar daugiau ;)
Eksperimentinis Schrödingerio atominio modelio pagrindas
Prieš Erwino Schrödingerio studijas buvo padaryta svarbi pažanga materijos supratimas pradžioje. Tokie eksperimentai inicijavo teorinių žinių sritį, žinomą kaip kvantinė mechanika, kuri suteikia interpretacijų apie dalelių, artimų atominei skalei arba žemiau jos, elgesį. Šioje specifinėje visatoje klasikinės fizikos dėsniai, dar žinomi kaip Niutono fizika, dažnai netaikomi arba jų nepakanka tam tikram elgesiui paaiškinti.
Kad suprastume, galime pasakyti, kad kvantinė mechanika prasideda nuo temos, vadinamos ultravioletine katastrofa. Pagal klasikinę fiziką juodas kūnas (karštas objektas), kurio temperatūra skiriasi nuo nulio, skleidžia intensyvią ultravioletinę spinduliuotę, be gama spinduliuotės ir rentgeno spindulių.
Tai reiškia, kad mes, žmonės, esant 36–37 °C temperatūrai, švytėtume tamsoje (uždegimo pasekmė). Nereikia nė sakyti, kad tai visiška nesąmonė, nes jei taip būtų, nebūtų tamsos.
Šiame kontekste, 1900 m. Maxas Planckas sukūrė koncepciją kiek, verčiamas kaip „energijos paketai“, siekiant paaiškinti energijos mainus tarp materijos ir spinduliuotės. Jo aiškinimu, žemoje temperatūroje esantis kūnas (kaip ir mes) neturi pakankamai energijos skleisti aukšto dažnio ultravioletinę spinduliuotę.
Taigi, aukšto dažnio ultravioletinę spinduliuotę kūnas gali skleisti tik tada, kai įgyja minimalų reikalingą energiją. Esant tokiai būklei, energijos mainai tarp materijos ir aplinkos vyksta per spinduliuotės energijos paketus.
Energijos paketai taip pat skiriasi nuo klasikinės fizikos. Kalbant apie energijos paketus, tai reiškia energiją, kuri yra kvantuojama, tai yra, ji yra specifinė, yra nustatytų ribų. Niutono fizikoje energijos kiekis, keičiamas tarp dviejų objektų, neturi jokių apribojimų.
Fotoelektrinis efektas
Kad Plancko pasiūlytos teorijos būtų tvirtesnės, reikėjo daugiau įrodymų. Šiame kontekste atsirado fotoelektrinis efektas., kuriame kalbama apie elektronų išmetimą iš metalo, kai ant jo paviršiaus patenka ultravioletinė spinduliuotė.
Remiantis šios teorijos pastebėjimais, jokie elektronai neišstumiami tol, kol spinduliuotė pasiekia tam tikros vertės dažnį, būdingą kiekvienam metalui. Pasiekus šį dažnį, elektronai iš karto išmetami, ir kuo intensyvesnis krintančios spinduliuotės dažnis, tuo greitesnis bus išmestas elektronas.
A fotoelektrinio efekto paaiškinimą pateikė Albertas Einšteinas. Pasak Einšteino, elektromagnetinė spinduliuotė (pvz., šviesa yra elektromagnetinė spinduliuotė), naudojama elektronams išmesti, buvo sudaryta iš dalelės, žinomos kaip fotonai, be to, kiekvienas fotonas gali būti interpretuojamas kaip energijos paketas. Remiantis Plancko tyrimais, buvo galima daryti išvadą, kad ultravioletinės spinduliuotės fotonai yra energingesni nei matomos šviesos fotonai.

Susidūrę su metalo paviršiumi fotonai (elektromagnetinės spinduliuotės sudedamosios dalys) keičiasi energija su ten esančiais elektronais. Jei susidūrimo su fotonais elektrono sugerta energija yra pakankamai didelė, tada jis bus išmestas. Norėdami sužinoti daugiau apie fotoelektrinį efektą, spustelėkite čia.
bangos-dalelės dvilypumas
Fotoelektrinis efektas atnešė tvirtą pagrindą, kad elektromagnetinė spinduliuotė susideda iš dalelių (fotonų). Tačiau daugelis kitų eksperimentų parodė, kad elektromagnetinė spinduliuotė elgėsi kaip banga. Iš šių eksperimentų ryškiausias buvo difrakcija – fizinis reiškinys, stebimas, kai banga susiduria su kliūtimi arba, kitaip interpretuojant, bangų gebėjimas įveikti kliūtis.
O Šviesos banginis pobūdis buvo žinomas nuo 1801 m, kai anglų fizikas Thomas Youngas apšvietė užtvarą su plyšiu. Kai ji praeina pro šį plyšį, šviesa difrakcija vyksta. Prie kiekvieno plyšio, įskaitant tai, kad šviesa praeina, net ir išsklaidyta, ji patiria naują difrakciją.

Kaip šitas, reikėjo priimti naują elektromagnetinės spinduliuotės elgesį: bangos ir dalelės dvilypumas. Iš ten prancūzų mokslininkas Louisas de Broglie išplėtė šią sąvoką, teigdamas, kad visos dalelės taip pat turėtų būti suprantamos kaip turinčios bangų elgesį.
De Broglie hipotezė sustiprėjo 1925 m., kai amerikiečių mokslininkai Clintonas Davissonas ir Lesteris Germeris įrodė, kad elektronų pluoštas gali difrakciją, kai praeina per vieną kristalą nikelio.
Šis suvokimas buvo būtinas norint padaryti išvadą, kad sunkesnės dalelės, tokios kaip molekulės, taip pat galėjo patirti difrakciją ir dėl to pasižymėti bangomis. Norėdami sužinoti daugiau apie bangų ir dalelių dvilypumą, spustelėkite čia.
neapibrėžtumo principas
Klasikinėje fizikoje nesunku nustatyti dalelės kelią. Tačiau kvantiniame pasaulyje, kuriame dalelės taip pat elgiasi kaip bangos, jų trajektorija nebėra tokia tiksli. Tai todėl nėra prasmės kalbėti apie bangos vietą.
Pavyzdžiui, gitaroje, kai plėšiate stygą, banga pasklinda per visą ilgį. Jei dalelė elgiasi taip pat, nėra būdo tiksliai apibrėžti jos vietą žinant jo linijinį impulsą (kiekis, sumaišantis masę ir greitį).
Todėl elektronas, kuris taip pat turi dvigubą charakterį, neturi apibrėžtos orbitos / kelio aplink atomo branduolį, kaip daugelis mano. Atada dvilypumas sukuria netikrumą dėl tikslios dalelės padėties.
Šis padėties apibrėžimo neapibrėžtumas yra nereikšmingas labai sunkiems kūnams, tačiau visiškai reikšmingas atominio dydžio arba subatominė, tai yra, jei žinote, kad dalelė yra tam tikroje vietoje, tam tikru momentu, nebežinote, kur ji bus kitame akimirksniu.
Iš šios dilemos kilo neapibrėžtumo principas.1927 m. įsteigė vokiečių fizikas Werneris Heisenbergas. Pagal šį principą neįmanoma žinoti dalelės padėties ir tiesinio impulso be paklaidos ribos, tai yra, jei viena savybė žinoma, kita – ne. Norėdami sužinoti daugiau apie neapibrėžtumo principą, spustelėkite čia.
Schrödingerio atominio modelio ypatybės
Kadangi dėl dvejopo dalelės charakterio nebebuvo įmanoma jai apibrėžti konkrečios trajektorijos, austrų mokslininkas Erwinas 1927 m. Schrödingeris šią tikslią trajektoriją pakeitė bangine funkcija, pavaizduotas graikiška raide psi (ψ), o šios funkcijos reikšmės skiriasi priklausomai nuo padėties. Banginės funkcijos pavyzdys yra sinusinė funkcija x.
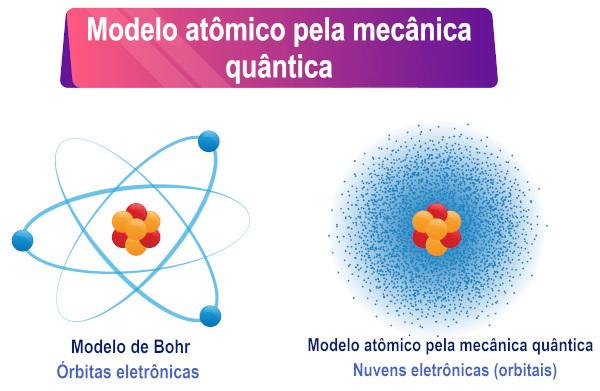
Tada mokslininkas Maxas Bornas sukūrė fizinę bangos funkcijos interpretaciją, teigdamas, kad funkcijos ψ kvadratas, tai yra ψ², būtų proporcingas tikimybei rasti dalelę regione. Taigi, ψ² suprantamas kaip tikimybės tankis rasti dalelę tam tikrame regione. Kadangi tai yra tikimybės tankis, ψ² reikšmė turi būti padauginta iš tūrio, kad būtų gauta tikroji tikimybė.
Norėdami apskaičiuoti bangos funkciją, Schrödingeris sukūrė lygtį, supaprastinta taip:
Hψ = Eψ
Hψ turėtų būti skaitomas kaip „psi Hamiltonas“ ir apibūdina bangos funkcijos kreivumą. Hamiltonas yra matematinis operatorius, kaip ir pliusas, minusas, žurnalas ir kt. Dešinė pusė atneša mums atitinkamą energiją.
Šios lygties sprendimas leidžia padaryti svarbią išvadą: dalelės gali turėti tik atskirą energijąs, tai yra gerai nustatytos energijos arba kvantuotos, o ne bet kokios vertės. Šios specifinės energijos vertės yra žinomos kaip energijos lygiai. Tai yra bangos funkcijos primetimas, nes ji turi tilpti į tam tikrą erdvės sritį. Klasikinėje mechanikoje objektas gali turėti bet kokią bendrosios energijos vertę.
Kaip šitas, elektronas negali turėti jokios energijos, bet gerai apibrėžtas energijos lygis. Kadangi bangos funkcija turi atitikti erdvės sritį, atminkite, kad a elektronas yra apribotas atomo viduje per traukos jėgas, kurias jis turi branduoliui.
Atomo energijos lygius galima apskaičiuoti tinkamai išsprendus Šriodingerio lygtį. Šiuo atveju pastebima, kad skiriamoji geba pasiekia naują lygtį, kuri parodo, kad kiekvieno atomo lygio energija priklauso nuo sveikojo skaičiaus, vadinamo n, kuris patvirtina mintį, kad energijos lygiai turi konkrečias reikšmes.
Taigi, priskiriant teigiamas reikšmes n (1, 2, 3...), galima apskaičiuoti atominių lygių energiją. Parametras n dabar vadinamas pagrindiniu kvantiniu skaičiumi, nes jis yra susietas su kiekvienu atomo lygiu, leidžiamu atomui.
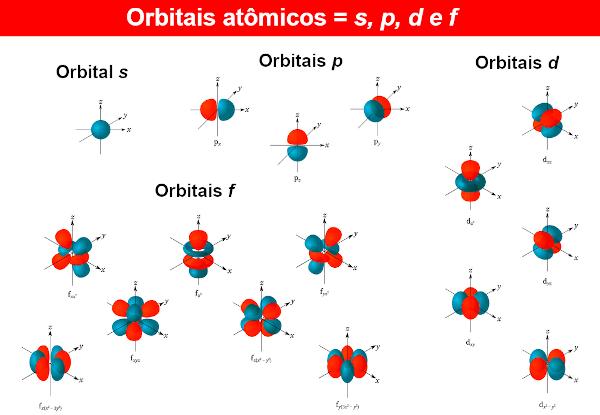
Į elektronų bangų funkcijos vadinamos atominėmis orbitomis, kurio matematinės išraiškos taip pat gaunamos sprendžiant Šriodingerio lygtį. Atominė orbita parodo elektrono pasiskirstymą atome, tai yra elektrono egzistavimo atome tikimybės sritį. Atominės orbitos gali būti skirtingos formos ir energijos, taip pat gaunamos pagal Schrödinger lygtį.
Kiekvienam energijos lygiui n (Prisiminus tai n gali būti 1, 2, 3...), yra n polygiai. Kiekviename polygyje yra skirtingų formų orbitos. Skirtingoms orbitalėms nėra jokių apribojimų, tačiau iki šiol žinomi atomai chemikai naudoja tik keturis iš jų, identifikuojamus raidėmis. s, P, d tai yra f.
Taigi, pavyzdžiui, lygiu n = 1, yra tik vienas polygis, taigi yra tik orbita s. Dabar apie lygį n = 2, yra du polygiai, o orbitos yra s tai yra P.
Schrödingerio atominio modelio pažanga, palyginti su kitais atominiais modeliais
Kaip minėta, Schrödingeris nebūtinai pateikė modelį, o matematinę interpretaciją. stebimiems reiškiniams, susijusiems su dalelių prigimtimi. Todėl jos aiškinimas tampa sudėtingas, nes pačiai Schrödingerio lygčiai reikia pažangių matematinių žinių, kad ji būtų išspręsta ir netgi interpretuojama.
Tačiau, Schrödingerio tyrimai atnešė didelį tvirtumą, kad pateisintų atomų ir elektronų energiją dovanos. Pavyzdžiui, Schrödingerio lygties skiriamoji geba patvirtina Bohro atominį modelį vandenilio atomui ir kitiems hidrogenoidiniams atomams (tiems, kurie turi tik 1 elektroną). Kaip ir Schrödingeris, Bohras pasiekė leistiną vandenilio atomo energijos lygį.
Tačiau Bohro atominis modelis negali pasiekti elektroninių lygių atomams, turintiems daugiau nei 1 elektroną, todėl parodo pagrindinį jo silpnumą. Kai yra du elektronai, būtina atsižvelgti į elektroninį atstūmimą tarp jų – parametrą, kurį galima pridėti prie Schrödingerio pasiūlyto matematinio supratimo.
Kitas svarbus Schrödingerio studijų dalykas – kvantinių sąvokų, tokių kaip dalelės dvilypumas, pritaikymas, taip pat tiksli elektrono trajektorija. Atominės orbitos apibrėžimas yra labai svarbus norint suprasti visų atomų struktūra. A tikimybės tankis (ψ²) padeda suprasti, kaip elektronai užima atomines orbitas polielektroniniuose atomuose, suteikiant konkretesnės informacijos apie elektrono energiją.
Autorius Stefano Araujo Novais
Chemijos mokytojas
Sužinokite daugiau apie atomo struktūrą ir pagrindines jo daleles: protonus, neutronus ir elektronus.
Žinokite atominio modelio raidą istorijoje.
Spustelėkite ir sužinokite apie pagrindines Rutherfordo atominio modelio ypatybes ir eksperimentą, kuris įgalino jį suformuluoti.
Sužinokite, kokios yra pagrindinės charakteristikos, problemos ir iš kokių aspektų buvo pasiūlytas Tomsono atominis modelis!
Įeikite ir susipažinkite su Boro atomu, kuris buvo atominis modelis, pagrįstas postulatais, kurie sėkmingai apibūdino vandenilio atomą.