Reakcijos greičio dėsnis susieja cheminės transformacijos greitį su reagentų koncentracijomis medžiagos kiekiu (mol / L), kurią galima nurodyti taip:

Pvz., Apsvarstykite šią bendrą reakciją:
aA + bB → cC + dD
Tarkime, padidiname reagentų A ir B koncentraciją, kas nutiks reakcijos greičiui? Na, kadangi toje pačioje erdvėje padidės reaguojančių dalelių kiekis, tarp jų bus veiksmingesni susidūrimai, dėl kurių padidės reakcijos vystymosi greitis. Tai reiškia, kad tai padidins jūsų greitį.
Todėl reakcijos greitis yra tiesiogiai proporcingas reaguojančių medžiagų koncentracijai. Tačiau tai priklauso ir nuo temperatūros. Todėl turime tokią matematinę lygtį, kuri atspindi reakcijos greičio dėsnį:

Ant ko:
v = reakcijos greitis;
k = konstanta, priklausanti tik nuo temperatūros vertės;
α ir β = eksperimentiškai nustatyti rodikliai.
Tik tada, kai reakcija yra elementari, tai yra, ji vyksta vienu žingsniu, rodikliai yra lygūs subalansuotos cheminės lygties koeficientams: v = k. [THE]The. [B]B. Tačiau kitais atvejais reikia eksperimentiškai nustatyti tinkamą stiprumą, iki kurio turi būti padidinta kiekvieno reagento koncentracija.
Reakcijų greičio dėsnis eina daugeliu pavadinimų, čia yra keletas: Masinio veikimo dėsnis, greitumo lygtis, kinetinis reakcijos dėsnis ir Guldberg-Waage dėsnis.
Apsvarstykite pavyzdį, kaip taikyti šį įstatymą:
Apsvarstykite šią elementarią reakciją:
2 HCl g) → H2 g) + Cl2 g)
a) Parašykite šios reakcijos greičio lygtį;
b) Atliekant eksperimentus, šios vandenilio chlorido dujų skaidymo reakcijos greitis ir šio reagento koncentracija esant pastoviai 25 ° C temperatūrai buvo pažymėti toliau pateiktoje lentelėje:
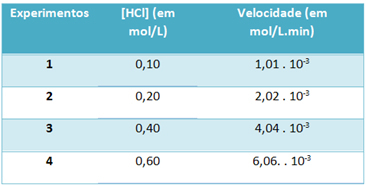
Remdamiesi tuo, nustatykite būdingą šios reakcijos greičio konstantą minėtoje temperatūroje.
Rezoliucija:
) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
Norėdami išspręsti raidę „b“, galite naudoti bet kurio eksperimento duomenis, kad gauta vertė bus tokia pati.
Bet ką daryti, jei reakcija nėra elementari? Kaip bus galima išspręsti tokius klausimus kaip ne elementarios reakcijos? Norėdami sužinoti, kaip tai padaryti, skaitykite ne elementarių reakcijų greičio dėsnį.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm
