At degimo reakcijos jie yra daugelyje mūsų kasdienio gyvenimo aspektų. Pavyzdžiui, pagrindiniai energijos gamybos šaltiniai susidaro deginant arba deginant tam tikrą kurą, pvz., etanolį, benziną, medžio anglį ir kt. Be to, energija, kurios mums reikia norint išgyventi ir dirbti, yra degimo reakcijų, vykstančių mūsų ląstelėse, kai „sudeginame“ maistą, kurį valgome, rezultatas.
Bet ko reikia, kad vyktų degimo reakcija?
Reikia trijų dalykų:
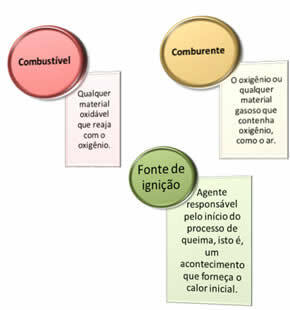
Šie trys veiksniai sudaro ugnies trikampis, nes prasidėjus degimo reakcijai, išsiskirianti energija palaiko reakciją ir leidžia jai tęstis tol, kol nebelieka kuro, oksidatoriaus ar šilumos (išleidžiamos energijos). Tai reiškia, kad bus a Grandininė reakcija.
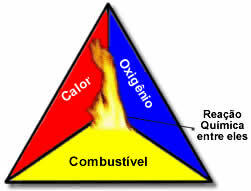
Pavyzdžiui, jei kas nors miške išmes uždegtą cigaretę, kils gaisras (degimo reakcija). Šiuo atveju, krūmas tai kuro, O deguonies, esančio ore atmosfera yra oksidatorius tai cigarečių užsidegė užsidegimo šaltinis. Šis deginimas tęsis tol, kol bus pašalintas vienas iš trijų veiksnių. Jei ugniagesiai išmes vandenį, karštis bus pašalintas. Bet net jei nieko nebus daroma, kad šis deginimas būtų sustabdytas, jis kažkada baigsis, tai yra, kai baigsis kuras (miškas).
Kaip jau minėta, šiose reakcijose išsiskiria šiluma, todėl degimas yra egzoterminė reakcija. Tačiau tokio tipo reakcija yra nepilnas degimas. Norėdami suprasti, kodėl, pažiūrėkite, kuo skiriasi visiškas ir nepilnas degimas:
Visiškas degimas:
Analizuodami organinius junginius kaip kurą, turime:
| THE visiškas degimas jis įvyks, kai anglies grandinė bus nutraukta ir visi anglies atomai anglies grandinėje bus visiškai oksiduoti. |
| Tu suformuoti produktai angliavandeniliai bus CO2 (anglies dioksidas) ir H2O (Vanduo). |
Stebėkite, kaip visiškai sudega izooktanas, kuris yra vienas iš benzino komponentų.
Ç8H18(g) +25/2 O2 (g) → 8 CO2(g) + 9 valandos2O(1)
nepilnas degimas
| Šiuo atveju nėra pakankamai oksidatoriaus, tai yra, pakankamai deguonies, kad sudegintų visą kurą. |
| Taigi, susidarę produktai yra CO (anglies monoksidas) ir H2O. |
Stebėkite tą patį izoktano degimą, tačiau dabar nevisiškai:
Ç8H18(g) + 17/2 O2(g) → 8 CO (g) + 9 valandos2O(1)
Pavyzdys yra miškų deginimas, nes išmetamas CO kiekis susideda iš CO ir tam tikrų medžiagų, tokių kaip suodžiai (C), taip pat pelenai ir kiti paprasti ir sudėtingi organiniai junginiai. Azoto oksidas, ozonas ir aldehidai taip pat gali susidaryti dėl antrinių reakcijų dėl kitų komponentų buvimo ore.
Ç8H18(g) + 9/2 O2 (g) → 8C (g) + 9 valandos2O(1)
Autorius Jennifer Fogaça
Baigė chemiją
Brazilijos mokyklos komanda
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm
