THE makaronaiatominis, kaip rodo jo pavadinimas, tai atomo masė, paprastai simbolizuojama „mThe“ arba „MA“. Tačiau kadangi atomas yra labai mažas, žmogaus akims nematomas darinys, jo masės neįmanoma išmatuoti, pavyzdžiui, naudojant svarstykles. Taigi mokslininkai nustatė atomų masę, lygindami juos su kitų atomų masėmis.
Tai daroma ir su kitais įrenginiais. Pavyzdžiui, masės vienetas yra standartinis kilogramas, kuris atitinka 3,917 cm aukščio ir skersmens cilindrą, pagamintą iš 10% iridžio ir 90% platinos. Taigi jis tarnauja kaip palyginimas. Pavyzdžiui, jei mes „pasveriame“ objektą ant svarstyklių ir nustatome, kad jo masė yra 10 kg, tai reiškia, kad jo masė yra 10 kartų didesnė už pasirinktą standartą: 1 kg.
Tas pats pasakytina ir apie atomus. Pasirinktas standartas buvo anglis-12, o šiam atomui savavališkai buvo priskirta 12 u masė. „u“ yra atominės masės vienetas, todėl yra lygus 1/12 anglies atomo masės.
Pavyzdžiui, kai sakome, kad vandenilio atominė masė yra lygi 1 u, tai reiškia, kad ji yra tarsi jei anglį padalinsime į 12 dalių, vienos iš šių dalių masė yra lygi atomo masei vandenilis. Kitas pavyzdys yra siera, kurios atominė masė yra 32 u, o tai reiškia, kad jos masė yra 32 kartus didesnė nei 1/12 masės.
12Ç.1 u = 1/12 1 anglies atomo masės 12

Atominės masės vienetas yra 1/12 anglies-12 masės
Medžiagų molekulinė masė yra elementų atominių masių suma. Pavyzdžiui, deguonies atominė masė lygi 16 u, taigi deguonies dujų molekulės molekulinė masė (O2) yra lygus 32u.
Kadangi laboratoriniai metodai šiuo metu yra labai pažangūs, yra prietaisų, kurie tiksliai matuoja elementų atominę masę, pavyzdžiui, masės spektrometras. Taigi, galima tai žinoti 1 u yra lygus 1,66054. 10-24 g.
Minčių žemėlapis: Atominė masė

* Norėdami atsisiųsti minčių žemėlapį PDF formatu, Paspauskite čia!
Kadangi atominės masės nustatomos labai tiksliai, periodinėje lentelėje jos pateikiamos dešimtainių skaičių forma. Tačiau kai einame atlikti skaičiavimus, dažniausiai naudojame suapvalintą skaičių, išskyrus eksperimentus, kurie turi būti labai tikslūs. Pavyzdžiui, jei pažvelgsite į periodinę lentelę, pamatysite, kad deguonies atominė masė yra lygi 15 999 u, tačiau skaičiavimuose paprastai naudojame 16 u reikšmę. Taip atsitinka ir su anglimi, kurios atominė masė yra 12,01 u, kaip parodyta žemiau:
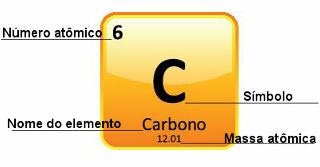
Anglies vaizdavimas periodinėje lentelėje
Periodinėje lentelėje esantys elementai iš tikrųjų yra visų elemento natūralių izotopų svertinis vidurkis. Taigi lentelėje rodoma atominė masė taip pat yra šių elementų atominių masių vidurkis. Pavyzdžiui, chloras (C?) turi du natūralius izotopus – 35 ir 37, kurių atitinkami procentai gamtoje yra 75,76 % ir 24,24 %. Kiekvieno iš šių izotopų atominės masės yra skirtingos: Cβ-35 yra 34,96885 u, o Cβ-37 - 36,96590.
Tokiu būdu elemento atominė masė apskaičiuojama atsižvelgiant į kiekvieno izotopo masę ir gausą, su kuria jis atsiranda gamtoje. Chloro atveju turime:
Elemento chloro atominė masė = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Elemento chloro atominė masė = 35,45
Tai yra chloro atominės masės vertė, rodoma periodinėje lentelėje.
* Minčių žemėlapis, autorius Aš. Diogo Lopesas
Autorius Jennifer Fogaça
Baigė raidėmis
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
