Pagrindinis skiriamasis redokso reakcijų bruožas yra tas, kad vienu metu viena cheminė medžiaga praranda elektronus (oksiduodama), o kita – įgyja elektronus (redukuojant).
Tačiau tam tikrose reakcijose galima pastebėti, kad vyksta ne tik oksidacija ir (arba) redukcija. Žemiau pateikiamas pavyzdys:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Apskaičiuojant visų šios reakcijos atomų oksidacijos skaičių (Nox), kaip nurodyta tekste „Oksidacijos skaičiaus (Nox) nustatymas“, turime:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Dabar patikrinkime, kurie iš jųmedžiagų Nox svyravimai, todėl oksidavosi ir redukuojasi:
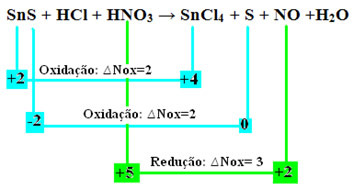
Atkreipkite dėmesį, kad įvyko dvi oksidacijos. Taigi, kaip tokiu atveju subalansuoti cheminę lygtį?
Svarbu atsiminti vieną dalyką, kuris taikomas visoms redokso reakcijoms atiduotų elektronų skaičius visada turi būti lygus gautų elektronų skaičiui.
Todėl norėdami subalansuoti tokio tipo reakciją, laikykitės tų pačių taisyklių, nustatytų tekste "Redokso balansavimas
“, tačiau tik su vienu pakeitimu: Dvi oksidacijas (SnS) sukėlusių rūšių Nox kitimo (∆Nox) nustatymas bus dviejų ∆Nox suma, kuri suteiks mums bendrą prarastų elektronų vertę:- SnS: ∆Bendrasis Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Bendras NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Taigi, norėdami subalansuoti, galime atlikti šiuos veiksmus:
- SnS: ∆Bendras NOx = 4 → 4 bus HNO koeficientas3;
- HNO3: ∆Nox = 3 → 3 bus SnS koeficientas.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO + H2O
Tęsiant balansavimą bandomuoju metodu:
- Kadangi jūs turite 3 Sn ir 3 S pirmame naryje, tai taip pat bus jūsų koeficientai 2-ajame naryje:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+NE+H2O
- Dėl to antrajam nariui liko 12 Cl (3. 4 = 12), taigi 12 bus medžiagos, kurioje Cl yra 1-ame nare, kuris yra HCl, koeficientas:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO + H2O
- Dabar turime 16 H pirmame naryje (12 + 4 = 16), taigi ir H koeficientas2O bus lygus 8, nes 8 padauginus iš vandenilio indekso, kuris yra 2, gaunamas 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Be to, 1-ajame naryje taip pat yra 4 N, taigi 4 taip pat bus N koeficientas 2-ajame naryje:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO + 8 H2O
Atkreipkite dėmesį, kad deguonies kiekis 1-oje galūnėje (3. 4 = 12) yra lygus bendram to elemento kiekiui 2-oje galūnėje (4 + 8 = 12). Taigi reakcija yra subalansuota.
Autorius Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm