Molekula yra stabili dviejų ar daugiau atomų, vienodų ar skirtingų, grupių, sujungtų per kovalentinius ryšius, grupė.
Molekuliniai junginiai klasifikuojami pagal poliškumą.
- Apolarinės molekulės: tarp atomų nėra elektronegatyvumo skirtumų.
- Poliarinės molekulės: tarp atomų yra elektronegatyvumo skirtumas, turint teigiamą ir neigiamą polius.
Kai molekulę sudaro daugiau nei vienas cheminis elementas, elektroninių debesų ir ligandų skaičius prie centrinio atomo lemia poliškumą.
nepolinės molekulės
Molekulių atomai yra sujungti kovalentiniais ryšiais, tai yra, elektronai yra bendri.
elektronegatyvumas tai yra atomo sugebėjimas pritraukti elektronus prie savęs ryšiu, formuodamas polius molekulėje.
Elektronus pritraukiantis atomas, sukaupdamas neigiamą krūvį, tampa neigiamu poliu, o kitas - teigiamą polių.
Kai molekulę sudaro vieno cheminio elemento atomai, elektronegatyvumo skirtumų nėra ir molekulė yra atsiprašyti.

Paprastų medžiagų, tokių kaip O, molekulės2 ir ne2, yra suformuota
atomai to paties elemento; kita vertus, sudėtinių medžiagų molekulės turi bent du skirtingus elementus.
At molekulės CO2 ir BeH2 dėl geometrijos jie taip pat yra nepoliniai. Kadangi abiejų geometrija yra linijinė, galuose esantys atomai - deguonis ir vandenilis - traukia jungties elektronus vienas kito link, nes jie yra labiau neigiami.
Kairėje esančio atomo trauką atsveria atomo patrauklumas dešinėje. Kadangi ryšiai yra vienodi, tai yra, jie turi vienodą intensyvumą, bet skirtingas kryptis, molekulės nesudaro polių.
polines molekules
Kai molekulę sudaro skirtingi atomai, skiriasi elektronegatyvumas, tačiau jis yra molekulės geometrija kuris lemia, ar jis bus poliarinis, ar nepolinis.
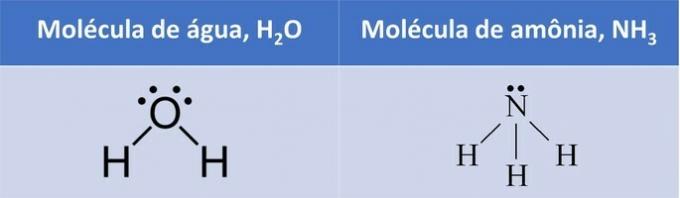
Abiejuose pavyzdžiuose matome, kad centriniai atomai - deguonis ir azotas - turi neporines elektronų poras, kurios formuoja elektronų debesis.
Kadangi aplink centrinį atomą yra daugiau elektronų debesų, nei prie jo yra pritvirtinti vienodi atomai, molekulė yra poliarinis.
Susidarius elektroniniam debesiui, molekulė įgauna struktūrą, kuri geriau talpina atomus, todėl vandens geometrija yra kampinė ir amoniako piramidinė.
Norite praturtinti savo žinias? Nepraleiskite žemiau pateiktų tekstų!
- Biomolekulės
- tarpmolekulinės jėgos
- molekulinė formulė
- Molekulinė masė
Mankšta su komentuojamais atsiliepimais
1. Nurodykite molekulių poliškumą:
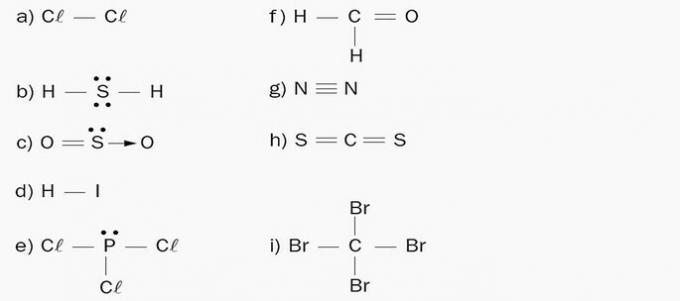
a) Apolar. Molekulę sudaro vienas cheminis elementas - chloras. Kadangi elektronegatyvumo skirtumų nėra, poliai nesusidaro.
b) Poliarinis. Prie centrinio elemento (S) yra 4 elektronų debesys ir 2 vienodi atomai (H).
c) Poliarinis. Prie centrinio elemento (S) yra 3 elektroniniai debesys ir 2 vienodi atomai (O).
d) Poliarinis. Molekulės elementai turi skirtingą elektronegatyvumą. Jodo susidaro neigiamas polius dėl neigiamo krūvio kaupimosi ir dėl to vandenilio pusė sudaro teigiamą polių.
e) Poliarinis. Prie centrinio elemento (P) pritvirtinti 4 elektronų debesys ir 3 vienodi atomai (Cl).
f) Poliarinis. Molekuloje yra asimetriškas krūvių pasiskirstymas, nes anglis turi skirtingus ligandus.
g) Apolar. Molekula yra diatominė ir susideda iš to paties cheminio elemento atomų, todėl elektronegatyvumo skirtumų nėra.
h) Apolar. Elektronų debesų skaičius yra lygus atomų, prijungtų prie centrinio atomo, skaičiui.
i) Apolar. Elektronų debesų skaičius yra lygus atomų, prijungtų prie centrinio atomo, skaičiui.
2. Apsvarstykite HF, HCl, H molekules2OI2, O2 ir CH4.
a) Klasifikuokite šias molekules į dvi grupes: polines ir nepolines.
| Poliarinis | apolarinis |
|---|---|
| Vandenilio fluoridas (HF) | Molekulinis vandenilis (H2) |
| Vandenilio chloridas (HCl) | Molekulinis deguonis (O2) |
| Vanduo (H2O) | Metanas (CH4) |
HF, HCl ir H2Jie yra poliniai, nes trijuose junginiuose vandenilis yra susijęs su labai elektronegatyviais elementais.
H2 tai2 jie yra nepoliniai, nes molekulėse nėra elektronegatyvumo skirtumų. CH4 jis taip pat nepolinis, nes elektronų debesų skaičius yra lygus elementų, pritvirtintų prie centrinio atomo, anglies, skaičiui.
Nuosavybė, susijusi su atomu: elektronegatyvumas.
Molekulės, sudarytos tik iš vieno cheminio elemento atomų, buvo klasifikuojamos kaip nepolinės, nes elektronegatyvumo skirtumų nėra.
Su molekule susijusi savybė: debesų kiekis ir lygių ligandų skaičius.
Skirtingų cheminių elementų atomų suformuotos molekulės buvo klasifikuojamos kaip polinės ar nepolinės pagal elektroninių debesų skaičių ir ligandų kiekį prie centrinio atomo.
Vanduo yra poliarinis, nes centriniame atome deguonyje yra nesuporuota elektronų pora, todėl joje yra 3 elektronų debesys ir 2 ligandai. Todėl krūvių pasiskirstymas yra asimetriškas, formuodamas molekulėje polius.
Metanas yra nepolinis, nes centrinio atomo, anglies, ligandų skaičius yra lygus elektroninių debesų skaičiui, todėl geometrija yra tetraedrinė ir molekulėje nėra poliškumo.
3. (Vunesp) Tarp žemiau pateiktų alternatyvų nurodykite tą, kurios teiginys neteisingas:
a) Kovalentinis ryšys yra tas, kuris atsiranda dalijantis elektronams tarp dviejų atomų.
b) Kovalentinis junginys HCl yra poliarinis, nes skiriasi vandenilio ir chloro atomų elektronegatyvumas.
c) Junginys, susidaręs tarp šarminio metalo ir halogeno, yra kovalentinis.
d) Br formulės medžiaga2 jis yra nepolinis.
e) Cal formulės medžiaga2 tai joninis.
Neteisinga alternatyva: c) Junginys, susidaręs tarp šarminio metalo ir halogeno, yra kovalentinis.
a) TEISINGA. Šis ryšių tipas atitinka elektronų dalijimąsi tarp nemetalų.
b) TINKAMA. Chloras turi didesnį elektronegatyvumą nei vandenilis, todėl pritraukia elektronų porą nuo jungties prie savęs, sukeldamas krūvio disbalansą.
HCl molekulė yra polinė, nes dėl neigiamo krūvio kaupimosi chlore susidaro neigiamas polius ir, todėl vandenilio pusėje paprastai būna sukauptas teigiamas krūvis, formuojantis polį teigiamas.
c) NETEISINGA. Per jonines jungtis metalai sugeba dovanoti elektronus ir išlikti teigiamai įkrauti, formuodami katijonus; kita vertus, halogenai priima elektronus ir sudaro anijonus - rūšis, turinčias neigiamą krūvį.
d) TEISINGA. Molekula yra diatominė ir susideda iš to paties cheminio elemento atomų, todėl elektronegatyvumo skirtumų nėra.
e) TEISINGA. Jonu jungiantis, elektronus dovanoja arba priima atomai. Joniniame junginyje kalcis dovanoja du elektronus ir sudaro katijoną Ca2+. Jodas gauna elektronus iš kalcio ir sudaro neigiamai įkrautą rūšį, I2-.
Būtinai patikrinkite šiuos tekstus klausimais, susijusiais su šio turinio tema:
- joninės jungtys
- kovalentiniai ryšiai
- Ryšių poliškumas
- Paprastos ir sudėtinės medžiagos
- Bendrosios materijos savybės



