Garinimas tai perėjimas iš skystos būsenos į dujinę būseną. Jis atsiranda ant laisvo skysčių paviršiaus lėtai ir palaipsniui, esant bet kokiai temperatūrai.
Kai medžiaga yra skystoje būsenoje, tarp atomų ji turi mažesnę rišamąją jėgą nei kietoje būsenoje.
Šioje būsenoje molekulės yra toliau viena nuo kitos, nuolat maišomos ir juda skysčio viduje skirtingu greičiu.
Tokiu būdu didesnio greičio dalelės, pasiekusios laisvą skysčio paviršių, sugeba išbėgti, pereidamos į dujinę būseną.

Garavimo greitis
Yra veiksnių, turinčių įtakos garavimo greičiui, jie yra:
- Temperatūra: kuo aukštesnė temperatūra, tuo greitesnis garavimo greitis. Nes kuo aukštesnė temperatūra, tuo aukštesnė kinetinė energija dalelių. Tokiu būdu iš skysčio paviršiaus pateks daugiau dalelių.
- Skysčio pobūdis: yra medžiagų, kurios lengviau išgaruoja, jos vadinamos lakiomis medžiagomis. Lakiųjų medžiagų pavyzdžiai yra eteris, alkoholis ir acetonas.
- laisvo paviršiaus ploto: kadangi garavimas vyksta ant laisvo skysčių paviršiaus, kuo didesnis paviršius, tuo didesnis dalelių kiekis paliks skystį.
- Garų koncentracija skystyje: kuo didesnis garo kiekis, tuo mažesnis garavimo greitis.
- Skysčio slėgis: kuo didesnis slėgis, tuo mažesnis garavimo greitis.
Skirtumas tarp garinimo ir virimo
Tiek garinimas, tiek verdamas atspindi perėjimą nuo skysčio į dujinę būseną. Tačiau nors garavimas vyksta palaipsniui, virinimas vyksta greitai.
Kad virtų, skystis tam tikram slėgiui turi pasiekti tam tikrą temperatūrą, vadinamą virimo temperatūra. Garavimas gali vykti bet kurioje temperatūroje.
Mišinių atskyrimas
Frakcioninė kristalizacija yra heterogeninių mišinių atskyrimo procesas. Jis naudojamas, kai mišinį sudarančios medžiagos yra kietos.
Šiame procese į mišinį pridedamas skystis, ištirpinantis visus kietus komponentus. Po to, kai tirpalas išgaruoja, komponentai kristalizuojasi atskirai.
Šis procesas naudojamas, pavyzdžiui, druskos keptuvėse druskoms iš jūros vandens gauti.

Garavimas ir vandens ciklas
Garavimas yra vienas iš procesų, kurie sudaro vandens ciklas. Saulės energija šildo laisvą ežerų, upių, jūrų ir vandenynų paviršių.
Dėl šio kaitinimo dalis vandens išgaruoja į garų būseną. Tai, pasiekusi aukščiausius atmosferos sluoksnius, atvėsina ir kondensuojasi, formuodama debesis.
Atsiradus krituliams, vanduo grįžta į paviršių skystu pavidalu, įsiskverbdamas į dirvą ir formuodamas požeminius lakštus.
Dalį šio vandens sugeria augalai, kurie pernešdami vandens garus grąžina į atmosferą.
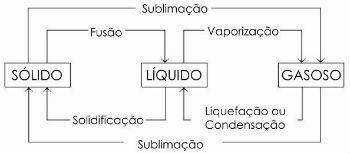
fazių pokyčiai
Paprastai vadinamas perėjimas iš skystos į dujinę būseną garinimas, nes be garinimo apima ir kitus du procesus: virimą ir kaitinimą.
Vis dar yra kitų būsenos pokyčių procesų. Ar jie:
- Susiliejimas
- Sukietėjimas
- Suskystinimas arba kondensatas
- Sublimacija
Žemiau pateiktoje diagramoje mes atstovaujame trims fizinės materijos būsenos ir atitinkami būsenos pokyčiai:
Sužinokite daugiau adresu: Fizikinės būsenos pokyčiai.



