Elektrolizė yra fizikinis-cheminis procesas, kurio metu naudojama elektros energija iš bet kurio šaltinio (pvz., baterija arba akumuliatorius) priversti vykstant cheminei reakcijai gaminti paprastas arba sudėtines medžiagas, kurių nėra gamtoje arba kurių nėra dideliais kiekiais.
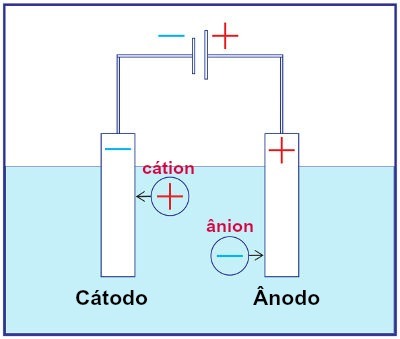
Bet kurios elektrolizės sistemos surinkimo atvaizdavimas
Elektrolizės metu katijonas patiria redukciją katode, o anijonas - anode. Tai atsitinka per išorinį šaltinį tiekiamą elektros iškrovą. Taigi, atliekant elektrolizę, mes turime savaiminę oksidacijos ir redukcijos reakciją.
Dabar supraskite du elektrolizės būdus:
Tokio tipo elektrolizėje mes naudojame a joninė medžiaga skystoje būsenoje elektrolitinėje talpykloje. Kai joninė medžiaga (XY) susilieja, ji vykdo atsiribojimas, kaip parodyta žemiau:
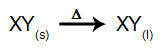

Tada, įjungus maitinimo šaltinį, katijonas (X+) juda link katodo, o anijonai (Y-) judėti link anodo. Taigi:
Prie katodo: katijonai gauna elektronus (jie redukuojami) ir transformuojasi į stabilią medžiagą (X), procesą rodo ši lygtis:
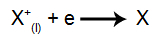
Prie anodo: anijonai praranda elektronus (jie oksiduojasi) ir tampa stabilia medžiaga (X), šį procesą apibūdina ši lygtis:

a) magminės elektrolizės pavyzdys
Kaip pavyzdį, dabar sekite magminę elektrolizę natrio chloridas (NaCl). Kai natrio chloridas (NaCl) susilieja, jam vyksta disociacijos procesas, kaip parodyta žemiau:
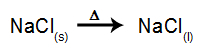
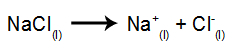
Tada, įjungus maitinimo šaltinį, katijonas (Na+) juda link katodo, o anijonai (Cl-) judėti link anodo. Taigi:
Prie katodo: katijonai+ jie gauna elektronus (jie redukuojami) ir tampa stabilia medžiaga (Na, kuris yra kietasis metalas), procesą apibūdina toliau pateikta lygtis:

Prie anodo: Cl anijonai- jie praranda elektronus (jie oksiduojasi) ir tampa stabilia medžiaga (Cl2, kuris yra dujinis), procesas pateikiamas žemiau pateikta lygtimi:

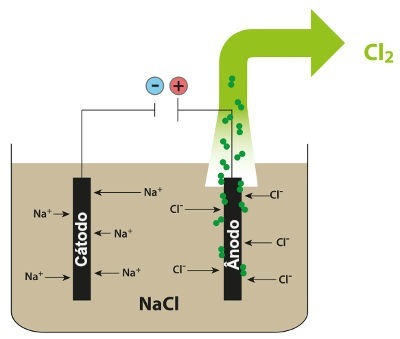
Schema, rodanti magnio elektrolizę NaCl
Taigi, atliekant magminę natrio chlorido elektrolizę, susidaro metalinės natrio (Na) ir chloro dujos (Cl2).
Tokio tipo elektrolizėje elektrolitinės talpos viduje naudojame vandenyje ištirpusią joninę medžiagą. Taigi, prieš atlikdami elektrolizę, pirmiausia sumaišome medžiagą (paprastai druską neorganinis) vandenyje, kad atsirastų jo disociacija (išsiskirtų katijonas ir anijonas), kaip parodyta žemyn:
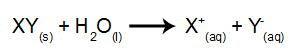
Magminės elektrolizės skirtumas yra tas, kad be disociacijos jonų, mes taip pat turime vandens savaiminės jonizacijos. Vandens savijonizacijos metu susidaro hidronio katijonas (H+) ir hidroksido anijoną (OH-), kaip žemiau pateiktoje lygtyje:

Taigi elektrolitinėje talpykloje yra du katijonai (vienas iš medžiagos joninis ir vienas iš vandens) ir du anijonai (vienas iš joninės medžiagos, kitas - iš Vanduo).
Norint žinoti, kuris katijonas pereis į katodą, o kuris anijonas - į anodą, būtina žinoti katijonų ir anijonų išleidimo tvarką.
Katijonams:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hidronis> IIIA šeima> IIA šeima> IA šeima
anijonams
Anionai be deguonies ir HSO4 > hidroksidas> deguonies turinčiai anijonai ir F
Tada, įjungus maitinimo šaltinį, katijonas (X+) juda link katodo, ir vienas iš anijonų (Y-) juda link anodo.
Prie katodo: katijonai gauna elektronus (jie redukuojami) ir transformuojasi į stabilią medžiagą (X), procesą apibūdina žemiau pateikta lygtis:

Prie anodo: anijonai praranda elektronus (jie oksiduojasi) ir tampa stabilia medžiaga (Y), šį procesą apibūdina žemiau pateikta lygtis:
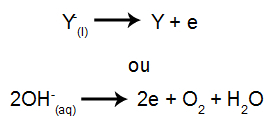
a) Vandeninės elektrolizės pavyzdys
Kaip pavyzdį naudosime vandeninę natrio chlorido (NaCl) elektrolizę. Kai natrio chloridas (NaCl) ištirpinamas vandenyje, jam vyksta disociacijos procesas, kaip parodyta žemiau:
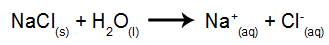
Be NaCl disociacijos, mes savaime jonizuojame vandenį:

Taigi turime H katijonus+ ir toliau+ ir OH anijonai- ir Cl-. Tada, kai įjungiamas maitinimo šaltinis, turime:
prie katodo: H katijonai+ gauna elektronus (redukuotus) ir tampa stabilia medžiaga (H2, kuris yra dujos). Taip yra todėl, kad hidronis turi išskyros prioritetą prieš IA šeimos elementus (šiuo atveju Na). Procesą vaizduoja žemiau pateikta lygtis:
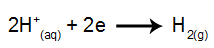
prie anodo: Cl anijonai- jie praranda elektronus (jie oksiduojasi) ir tampa stabilia medžiaga (Cl2, kuris yra dujinis). Taip yra todėl, kad Cl- tai yra deguonies neturintis anijonas ir jo išsiskyrimo prioritetas yra didesnis nei hidroksido - procesą apibūdina ši lygybė:


Schema, rodanti vandeninę NaCl elektrolizę
Taigi vandeninėje natrio chlorido elektrolizėje susidarome vandenilio dujas (H2) ir chloro dujos (Cl2).
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm
