Kad suprastumėte jonizacija pirmiausia reikia žinoti, kas yra jonai. Atkreipkite dėmesį į toliau pateiktą paaiškinimą:
Kiekvienas atomas turi vienodą protonų ir elektronų skaičių; todėl kiekvienas atomas yra elektra neutralus. Be to, medžiagos, sudarytos iš atomų grupių, taip pat turi elektrinį krūvio balansą, nes yra elektriškai neutralios.
Tačiau, atomas ar atomų grupė gali prarasti ar įgyti elektronus; kai taip atsitinka, jie praranda neutralumą ir tampa jonais.
Jei atomas ar atomų grupė praranda elektronus, jis bus teigiamai įkrautas ir tai bus vadinamas jonas katijonas. Tačiau jei gausite elektronų, krūvis bus neigiamas, o jonas - a anijonas.
Neorganinės medžiagos yra joninės arba gali sudaryti jonus.
Vienas iš jonų susidarymo būdų yra molekulinių medžiagų įdėjimas į vandenį, tai yra, susidaro kovalentiniais ryšiais, kuriuose dalijasi elektronai.
Pavyzdžiui, jei mes išbandysime druskos rūgšties (HCl) elektrinį laidumą vandeniniame tirpale (vandenilio chloridas) ištirpęs vandenyje), pamatysime, kad tirpalas yra elektrolitinis, tai yra, jis vykdo elektros srovę, nes šiame sprendimas.

Tai reiškia, kad vanduo veikė kaip reagentas, formuodamas jonus iš druskos rūgšties. Tai įvyksta pagal toliau pateiktą reakciją:
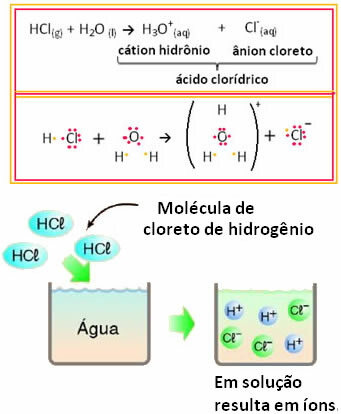
Atkreipkite dėmesį, kad prieš dedant vandenilio chloridą į vandenį, jonų nebuvo. Tačiau jo molekulės sureagavo su vandeniu ir susidarė teigiami H jonai3O+ (katijonai) ir neiginiai Cl- (anijonai). Kadangi chloras yra labiau elektronegatyvus nei vandenilis, jis pritraukia elektronų porą iš arti esančios kovalentinės jungties ir sudaro anijoną. Kita vertus, vandenilį traukia vandenyje esantis deguonis, kuris yra labiau neigiamas nei chloras; o tarp vandenilio ir deguonies susidaro kovalentinis ryšys, sukeliantis hidronio katijoną. Šis jonų susidarymo reiškinys vadinamasjonizacija.
Remdamiesi aukščiau pateiktu paaiškinimu, jonizaciją galime apibrėžti taip:

Atkreipkite dėmesį, kad jonų anksčiau nebuvo, nes jei jie egzistuotų, kaip ir ištirpus joniniams junginiams, mes turėtume joninę disociaciją, o ne jonizaciją.
Visos rūgštys, kurios liečiasi su vandeniu, jonizuojasi. Tačiau ne kiekvienas molekulinis junginys patiria jonizaciją.Pavyzdžiui, cukrus (C12H22O11) yra molekulinis, tačiau, įdėjus į vandenį, jonai nesusidaro, jis tiesiog ištirpsta, todėl gaunamas neelektrolitinis molekulinis tirpalas, kuris neveda elektros.
Jennifer Fogaça
Baigė chemiją
