Valentijos sluoksnis yra paskutinis atomo elektroninio paskirstymo sluoksnis. Kadangi tai yra išorinis sluoksnis, jis taip pat yra labiausiai nutolęs nuo atomo branduolio.
Pagal Aštuoneto taisyklė, valentiniam apvalkalui stabilizuotis reikia aštuonių elektronų.
Taigi atomai įgyja stabilumą, kai jų valentiniame apvalkale yra 8 elektronai. Tai atsitinka su tauriomis dujomis, jos turi visą valentinį sluoksnį. Vienintelė išimtis yra helis, turintis 2 elektronus.
Kiti elementai turi užmegzti cheminius ryšius, kad gautų trūkstamus elektronus ir pasiektų aštuonis elektronus valentiniame apvalkale.
Valentinio apvalkalo elektronai yra tie, kurie dalyvauja ryšiuose, nes jie yra labiausiai išoriniai.
Elektrosferos sluoksniai
Pagal Rutherfordo-Bohro atominį modelį elektronai sukasi aplink atomo branduolį, skirtinguose energetiniuose sluoksniuose.
Yra septyni sluoksniai, pažymėti raidėmis K, L, M, N, O, P ir Q. Kiekvienas palaiko maksimalų elektronų skaičių.
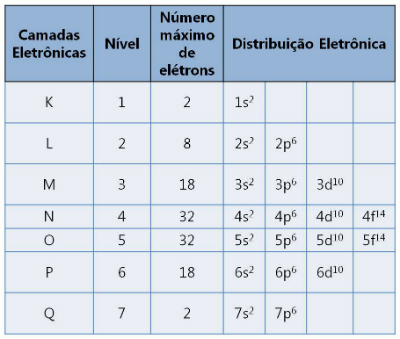 Elektroniniai sluoksniai ir jų palaikomi elektronų skaičiai
Elektroniniai sluoksniai ir jų palaikomi elektronų skaičiai
Taip pat skaitykite:
- Bohro atominis modelis
- „Rutherford“ atominis modelis
- Tauriosios dujos
- Aštuoneto taisyklė
Kaip nustatyti Valensijos sluoksnį?
Valentinį sluoksnį galima nustatyti dviem būdais: Eletroninis pasiskirstymas ir Periodinė elementų lentelė.
Norint nustatyti valentinį sluoksnį elektroniniu būdu, Linuso Paulingo diagrama.
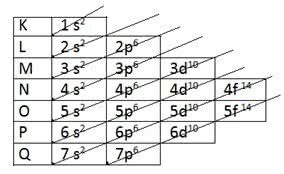 Paulingo diagrama
Paulingo diagrama
Prisiminkime, kad Paulingo diagrama atitinka didėjančią energijos tvarką. Paskutinis elektroniniame paskirstyme gautas sluoksnis yra valentinis sluoksnis.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Taigi, valentiniame sluoksnyje energingiausias pakopas yra paskutinis sluoksnis.
Pavyzdžiai:
Azotas - N
Atominis skaičius: 7
Elektroninis platinimas: 1s2 2s2 2p3
Valensijos sluoksnis: 2s2 2p3, N valentiniame apvalkale turi 5 elektronus.
Geležis - Fe
Atominis skaičius: 26
Elektroninis platinimas: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Valensijos sluoksnis: 4s2, Fe valentiniame apvalkale yra 2 elektronai.
Chloras - Cl
Atominis skaičius: 17
Elektroninis platinimas: 1s2 2s2 2p6 3s2 3p5
Valensijos sluoksnis: 3s2 3p5, Cl valentiniame apvalkale yra 7 elektronai.
Deguonis - O
Atomo numeris: 8
Elektroninis platinimas: 1s2 2s2 2p4
Valensijos sluoksnis: 2s2 2p4, deguonies valentiniame apvalkale yra 6 elektronai.
Anglis - C
Atomo numeris: 6
Elektroninis platinimas: 1s2 2s2 2p2
Valensijos sluoksnis: 2s2 2p2, anglies valentiniame apvalkale yra 4 elektronai.
Taip pat skaitykite apie Kvantiniai skaičiai.
Iki šiol naudoti pavyzdžiai buvo su pagrindinės būsenos elementais. Tačiau tuo pačiu principu galima naudotis jonai, katijonai ir anijonai. Žr. Pavyzdį:
Chlorido anijonas - Cl-
Chloro atominis skaičius yra 17. Jei jis būtų pagrindinėje būsenoje, elektronų skaičius būtų lygus protonų skaičiui. Tačiau šiuo atveju yra 1 elektrono stiprinimas.
Pirmiausia atlikite elektroninį chloro elemento paskirstymą:
1s2 2s2 2p6 3s2 3p5
Įgiję papildomą elektroną, paskutiniame sluoksnyje pridėkite:
1s2 2s2 2p6 3s2 3p6. Taigi valentiniame apvalkale yra 8 elektronai2 3p6).
Taip pat žiūrėkite: Elektroninio platinimo pratimai.
Norint nustatyti valentinį sluoksnį per periodinę lentelę, būtina nustatyti laikotarpį ir elementų šeimą.
Taigi, nors 1A šeima turi 1 valentinį elektroną, 2A turi 2 ir kt. Joje esantys cheminiai elementai periodinių stalų šeima valentiniame apvalkale turi tą patį elektronų skaičių.
Tačiau tai galioja tik 1, 2, 13, 14, 15, 16 ir 17 grupėms, kurių 1, 2, 3, 4, 5, 6 ir 7 valentiniame apvalkale yra toks elektronų skaičius.
Elementams, kur toks ryšys neįmanomas, turėtų būti naudojamas elektroninis platinimas.
Nepamiršk! At cheminiai ryšiai kyla iš poreikio stabilizuoti atomus ir tokiu būdu formuoti molekules. Tai daroma dovanojant elektronus iš valentinio apvalkalo, kurie, kadangi yra toliau nuo branduolio, turi polinkį aukoti.
Taip pat skaitykite apie Molekulinė geometrija.
Pratimai
1. Raskite šių elementų valentinį sluoksnį:
Bromas
35br
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Bromo valentinis apvalkalas (7A šeima) turi 7 elektronus. Taip yra todėl, kad 4-ieji2 ir 4p5 priklauso N sluoksniui, o 3d10 priklauso M. sluoksniui.
Aliuminis
13Al
1s2 2s2 2p6 3s2 3p1
Aliuminio valentinis apvalkalas (3A šeima) turi 3 elektronus.
2. (UFSC) Elektronų skaičius kiekviename stroncio atomo pakopoje (38Sr) didėjančia energijos tvarka yra:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. (IFSP / 2013) Elektronų skaičius kalcio atomo valentiniame apvalkale (Z = 20), esant pagrindinei būsenai, yra
iki 1
b) 2
c) 6
d) 8
e) 10
b) 2
Patikrinkite stojamojo egzamino klausimus komentuodami rezoliuciją: Periodinės lentelės pratimai.