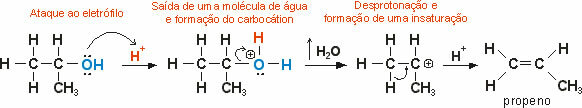
Periodinės cheminių elementų savybės yra jų turimos savybės.
Atkreipkite dėmesį, kad periodinės lentelės cheminiai elementai turi tam tikrą vietą, kuri skiriasi atsižvelgiant į periodines jų savybes. Jie rūšiuojami didėjančia atominio skaičiaus tvarka.
Pagal Moseley įstatymą:
“Daugelis fizikinių ir cheminių elementų savybių periodiškai skiriasi pagal elementų atomų skaičių seką..”
Pagrindinės periodinės savybės
atominis spindulys
Šią savybę, susijusią su atomų dydžiu, apibrėžia atstumas tarp to paties elemento dviejų atomų branduolių centrų.
Todėl atominis spindulys atitinka pusę atstumo tarp dviejų kaimyninių atomų branduolių, išreiškiamą taip:
r = d / 2
Kur:
r: žaibas
d: tarpbranduolinis atstumas
Jis matuojamas pikometrai (pm). Šis matavimas yra skaitiklio daugiklis:
13 val. = 10-12 m
Periodinėje lentelėje atominis spindulys didėja iš viršaus į apačią vertikalioje padėtyje. Horizontaliai jie didėja iš dešinės į kairę.

Atomo spindulio kitimas
Didžiausias atomo spindulys yra cezis (Cs).
Atominis tūris
Ši periodinė savybė rodo tūrį, kurį užima 1 mol kietojo kūno elemento.
Verta paminėti, kad atominis tūris yra ne 1 atomo tūris, o 6.02 rinkinys. 1023 atomai (1 mol vertė)
Atomo atominį tūrį apibrėžia ne tik kiekvieno atomo tūris, bet ir tarpas tarp tų atomų.
Periodinėje lentelėje atominės tūrio vertės didėja iš viršaus į apačią (vertikaliai) ir nuo centro iki krašto (horizontaliai).

Atomo tūrio kitimas
Norint apskaičiuoti atominį tūrį, naudojama ši formulė:
V = m / d
Kur:
V: atominis tūris
m: 6,02 masė. 1023 elementų atomai
d: kietojo kūno elementų tankis
Absoliutus tankis
tankis absoliutus, dar vadinamas „savita mase“, yra periodinė savybė, kuri nustato santykį tarp medžiagos masės (m) ir tos masės užimamo tūrio (v).
Jis apskaičiuojamas pagal šią formulę:
d = m / v
Kur:
d: tankis
m: makaronai
v: tūris
Periodinėje lentelėje tankio vertės didėja iš viršaus į apačią (vertikaliai) ir nuo kraštų iki centro (horizontaliai).

Absoliutus tankio kitimas
Taigi tankiausi elementai yra lentelės centre ir apačioje:
Osmis (Os): d = 22,5 g / cm3
Iridis (Ir): d = 22,4 g / cm3
Lydymosi temperatūra ir virimo temperatūra
Kita svarbi periodinė savybė yra susijusi su temperatūra, kurioje elementai patenka tirpsta ir verda.
Lydymosi temperatūra (MP) yra temperatūra, kai medžiaga pereina iš kietos į skystą fazę. Virimo temperatūra (PE) yra temperatūra, kai medžiaga pereina iš skysčio į dujinę fazę.
Periodinėje lentelėje PF ir PE vertės skiriasi atsižvelgiant į lentelėje išdėstytas puses.
Vertikaliai ir kairėje stalo pusėje jie didėja iš apačios į viršų. Dešinėje pusėje jie didėja iš viršaus į apačią. Horizontalia kryptimi jie tęsiasi nuo galų iki centro.

Lydymosi ir virimo temperatūros pokyčiai
Elektroninis bendrumas
Taip pat vadinamas „elektroafiniškumu“, tai yra mažiausia energija, reikalinga cheminiam elementui, norint pašalinti elektroną iš anijono.
Tai yra elektroninis giminingumas nurodo energijos kiekį, išsiskyrusį, kai atomas gauna elektroną.
Atkreipkite dėmesį, kad šis nestabilus atomas yra vienas ir yra dujinės būsenos. Su šia savybe jis gauna stabilumą, kai gauna elektroną.
Priešingai nei atominis spindulys, periodinės lentelės elementų elektroafiniškumas auga iš kairės į dešinę, horizontaliai. Vertikalia kryptimi jis didėja iš apačios į viršų.

Elektroninis bendrų santykių variantas
Cheminis elementas, turintis didžiausią elektronų afinitetą, yra chloras (Cl), kurio vertė yra 349 KJ / mol.
Jonizavimo energija
Taip pat vadinama "jonizacijos potencialas“, Ši savybė prieštarauja elektroninio bendrumo savybėms.
Tai yra mažiausia energija, reikalinga cheminiam elementui, norint pašalinti elektroną iš neutralaus atomo.
Taigi ši periodinė savybė rodo, kiek energijos reikia norint perduoti elektroną iš pagrindinės būsenos atomo.
Vadinamoji „atomo pagrindinė būsena“ reiškia, kad jo protonų skaičius yra lygus jo elektronų skaičiui (p+ = ir-).
Taigi, pašalinus elektroną iš atomo, jis jonizuojamas. Tai yra, jis gauna daugiau protonų nei elektronai, todėl tampa katijonu.
Periodinėje lentelėje jonizacijos energija priešinga atominio spindulio energijai. Taigi jis didėja iš kairės į dešinę ir iš apačios į viršų.

Jonizacijos energijos kitimas
Didžiausią jonizacijos potencialą turintys elementai yra fluoras (F) ir chloras (Cl).
elektronegatyvumas
Elementų, turinčių polinkį elektronus priimti cheminėje jungtyje, savybė.
Tai vyksta kovalentinėmis jungtimis tuo metu, kai dalijamasi elektronų poromis. Priimdami elektronus, atomai lieka su neigiamu krūviu (anijonu).
Atminkite, kad tai laikoma svarbiausia periodinės lentelės savybe. Taip yra todėl, kad elektronegatyvumas sukelia atomų elgesį, iš kurio susidaro molekulės.
Periodinėje lentelėje elektronegatyvumas didėja iš kairės į dešinę (horizontaliai) ir iš apačios į viršų (vertikaliai)

Elektronegatyvumo kitimas
Taigi, labiausiai elektronegatyvus periodinės lentelės elementas yra fluoras (F). Kita vertus, cezis (Cs) ir frankis (Fr) yra mažiausiai elektronegatyviniai elementai.
elektropozityvumas
Skirtingai nuo elektronegatyvumo, ši elementų atomų savybė rodo polinkį prarasti (arba atsisakyti) elektronus cheminėje jungtyje.
Praradę elektronus, elementų atomai gauna teigiamą krūvį, taip suformuodami katijoną.
Ta pačia kryptimi kaip atomo spindulys ir priešingai elektronegatyvumui, periodinėje lentelėje a elektropozityvumas didėja iš dešinės į kairę (horizontaliai) ir iš viršaus į apačią (vertikaliai).

Elektropozityvumo kitimas
Didžiausią elektropozityvumą turintys cheminiai elementai yra metalai, todėl ši savybė taip pat vadinama „metaliniu charakteriu“. Labiausiai elektropozityvus elementas yra frankis (Fr), turintis didžiausią polinkį į oksidaciją.
Dėmesio!
Tu "tauriųjų dujų“Yra inertiški elementai, nes jie nevykdo cheminių jungčių ir beveik neatiduoda ar nepriima elektronų. Be to, jiems sunku reaguoti į kitus elementus.
Todėl į šių elementų elektronegatyvumą ir elektropozityvumą neatsižvelgiama.
Taip pat skaitykite:
- Cheminiai ryšiai
- Periodinės lentelės istorija
- Periodinės lentelės šeimos
Aperiodinės savybės
Be periodinių savybių, mes turime aperiodines savybes. Šiuo atveju reikšmės didėja arba mažėja priklausomai nuo elemento atominio skaičiaus.
Jie gauna šį vardą, nes nepaklūsta savo pozicijai periodinėje lentelėje kaip periodiniai. Tai yra, jie nėra kartojami reguliariais laikotarpiais.
Pagrindinės aperiodinės savybės yra šios:
- Atominės Mišios: Ši savybė didėja didėjant atominiam skaičiui.
- Specifinė šiluma: ši savybė mažėja didėjant atominiam skaičiui. Atminkite, kad specifinė šiluma yra šilumos kiekis, reikalingas 1g elemento temperatūrai padidinti 1 ° C.
Stojamojo egzamino pratybos su grįžtamuoju ryšiu
1. (PUC-RJ) Apsvarstykite teiginius apie IA grupės elementus periodinėje lentelėje
Aš Jie vadinami šarminiais metalais.
II. Jos atominiai spinduliai auga kartu su atominiu skaičiumi.
III. Jo jonizacijos potencialas didėja priklausomai nuo atominio skaičiaus.
IV: jo metalinis pobūdis didėja priklausomai nuo atominio skaičiaus.
Tarp teiginių yra teisingi:
a) I ir II
b) III ir IV
c) I, II ir IV
d) II, III ir IV
e) I, II, III ir IV
C alternatyva
2. (UFMG) Lyginant chlorą ir natrį, du cheminius elementus, kurie sudaro valgomąją druską, galite pasakyti, kad chloras:
a) yra tankesnis.
b) yra mažiau nepastovi.
c) turi didesnį metalinį pobūdį.
d) turi mažesnę jonizacijos energiją.
e) turi mažesnį atominį spindulį.
Alternatyvus ir
3. (UFC-CE) Fotoelektrinį efektą sudaro elektronų emisija iš metalinių paviršių per atitinkamo dažnio šviesos srautą. Šiam reiškiniui tiesioginę įtaką daro metalų jonizacijos potencialas, kurio iš esmės buvo naudojami gaminant fotoelektroninius prietaisus, tokius kaip: viešojo apšvietimo fotoelementai, kameros fotografinis ir kt. Remiantis periodinės lentelės elementų jonizacijos potencialo kitimu, pažymėkite alternatyvą, kurioje yra metalas, kuris greičiausiai turi fotoelektrinį efektą.
a) Fe
b) Hg
c) Cs
d) Mg
e) Ca
C alternatyva
Patikrinkite stojamojo egzamino klausimus komentuodami rezoliuciją Periodinės lentelės pratimai ir nepaskelbti klausimai šia tema Periodinės lentelės organizavimo pratimai.
Taip pat skaitykite:
- Periodinė elementų lentelė
- Eletroninis pasiskirstymas
- Cheminiai elementai
- Tarpmolekulinės pajėgos