apibrėžia save kaip hibridizacija neužbaigtų atominių orbitalių sąjunga. Orbita klasifikuojama kaip nebaigta, kai turi tik vieną elektronas jo vietoje vietoj dviejų. Peržiūrėkite neišsamios orbitos ir visos orbitos vaizdą:

A paveikslėlyje turime visą orbitą; B paveiksle - nepilna orbita.
Hibridizacija yra natūralus reiškinys, atsirandantis su kai kuriais cheminiais elementais, tokiais kaip fosforas, siera, anglis ir kt. Anglies hibridizacija leidžia šio elemento atomams užmegzti keturias chemines jungtis, tai yra, anglis sukuria tik keturias jungtis po hibridizacijos reiškinio.
Bet kodėl anglis hibridizuojasi ir užmezga keturias jungtis? Norėdami suprasti šį reiškinį, turime žinoti šio elemento elektroninį platinimą:
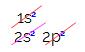
Elektroniniame anglies paskirstyme matome, kad 1s pakopas yra baigtas (su dviem elektronais), 2s yra pilnas (su dviem elektronais), o 2p potipis yra neišsamus (p pakopas palaiko šešis elektronus, tačiau yra tik du). Reprezentatyviai paskirstydami 2p elektronus, turime:
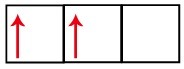
P pakopas turi tris orbitales - anglies atveju dvi iš jų yra neišsamios ir viena tuščia. Dėl šios priežasties šis elementas turėtų atlikti tik dvi nuorodas, nes neužbaigtų orbitalių skaičius visada lemia nuorodų skaičių.
Tačiau gaunant energiją iš išorinės aplinkos, anglyje esantys elektronai yra sužadinami. Taigi vienas iš elektronų, esančių 2 pakopoje, pereina į tuščios pakopos orbitą:
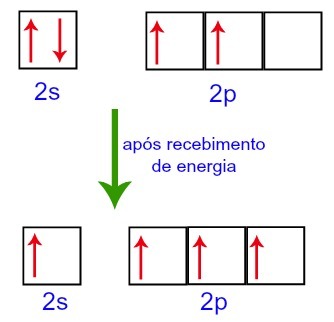
Anglies orbitos prieš gaunant energiją iš išorinės aplinkos ir po jos
Taigi anglis palieka keturias nepilnas orbitales antrame lygyje. Tada 2s pakopos orbita sujungia tris p orbitales, kurios sukonfigūruoja fenomeną hibridizacija.
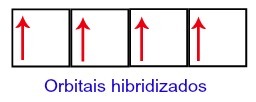
Anglies orbitos po hibridizacijos
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm


