Kai sakome žodį „pusiausvyra“, į galvą ateina neribotą laiką išliekantis objektas. Tačiau tai tik vienos rūšies pusiausvyra, vadinama „Statinė pusiausvyra“.
Taip pat yra „Dinaminė pusiausvyra“. Joje, kaip sakoma pavadinime, nėra nė vieno momento, kai nagrinėjamas objektas ar reiškinys tebėra. Pavyzdžiui, kad suprastumėte, žiūrėkite toliau pateiktą iliustraciją ir atkreipkite dėmesį, kad į indą patenkantis vandens kiekis yra lygus iš jo ištekančiam kiekiui, išlaikant pastovų vandens lygį. Tokiu atveju sakome, kad yra a dinamišką pusiausvyrą, judesio pusiausvyra.

Tai yra tokia pusiausvyra, kuri atsiranda grįžtamosios reakcijos, tai yra tose reakcijose, kurios vyksta abiem kryptimis. Tuo pačiu metu, kai reagentų molekulės transformuojasi į produktus, produktų molekulės reaguoja viena su kita, kad susidarytų reagentai. Reakcijos grįžtamumas rodomas rodyklėmis į abi puses:
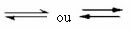
Kai tiesioginės reakcijos (produkto susidarymo) išsivystymo greitis yra lygus atvirkštinė reakcija (reagentų susidarymas) esant pastoviai temperatūrai reiškia, kad reakcija pasiekė pusiausvyrą cheminis.
Jei vyksta reakcijos, kai reaguojančiuose produktuose ir produktuose yra tik molekulių, turime a molekulinė pusiausvyra.Toliau pateikiamas reakcijos, vykstančios tarp vandenilio dujų (H2) ir jodo dujos (I2) vandenilio jodido (HI) dujoms susidaryti:
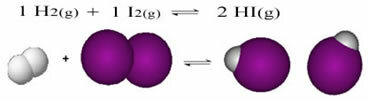
Reakcijos pradžioje tiesioginės reakcijos išsivystymo greitis buvo didesnis, nes visa reagentų koncentracija buvo maksimali, o produktų - nulinė. Taigi ir atvirkštinės reakcijos vystymosi greitis buvo lygus nuliui.
Tačiau laikui bėgant vandenilio ir jodo dujos reaguoja ir susidaro produktas. Tokiu būdu reagentų koncentracija pradeda mažėti, o jų vystymosi greitis taip pat mažėja.
Didėjant produktų koncentracijai ir mažėjant reagentų koncentracijai, atvirkštinės reakcijos vystymosi greitis pradeda didėti. Jei temperatūra bus palaikoma pastovi, ateis laikas, kai abu vystymosi greičiai išliks vienodi, taip parodydami, kad reakcija pasiekė cheminę molekulinę pusiausvyrą.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm
