Alotropija yra reiškinys, atsirandantis, kai tas pats cheminis elementas turi savybę suformuoti daugiau nei vieną paprastą medžiagą.. Šios alotropinės atmainos gali skirtis dėl molekulėje sujungtų elemento atomų skaičiaus arba dėl atomų išsidėstymo kristalinėje gardelėje.
Vienas iš elementų, turinčių alotropinių atmainų, yra fosforas (P), labiausiai paplitęs yra baltasis fosforas tai raudonasis fosforas. Šie du fosforo alotropai skiriasi ne skirtingu erdviniu išdėstymu, nes abu iš esmės susideda iš tetraedrinių molekulių, bet fosforo atomų kiekis kiekviename yra skirtingas.
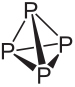
Peržiūrėkite baltojo ir raudonojo fosforo struktūrą ir pagrindines savybes:
- Baltasis fosforas:
Baltojo fosforo molekulinė formulė yra P4, o tai reiškia, kad jo molekulės susideda iš keturių fosforo atomų.

Šis fosforo tipas yra ypač reaktyvus, daugiausia dėl įtempimo 60 ° kampuose tarp jo jungčių. Jis yra toks reaktyvus, kad jį reikia laikyti vandenyje, kad jis nesiliestų su oru ir nesprogtų. Su juo reikia elgtis labai atsargiai, nes prarijus jis stipriai nudegina odą ir apsinuodija (pavartojus tik 0,1 g baltojo fosforo, gali ištikti mirtis).
Kaip matote žemiau, baltasis fosforas yra į vašką panaši kieta medžiaga.

Baltasis fosforas laikomas vandenyje, kad nesiliestų su oru *
Jei šildomas be oro, baltasis fosforas virsta raudonuoju fosforu.
- raudonasis fosforas:
Raudonasis fosforas neturi nustatytos struktūros, tačiau yra įrodymų, kad tai yra makromolekulės, susidariusios jungiantis minėtoms tetraedrinėms struktūroms (P4), atstovaujama Pne.
Jis yra daug mažiau reaktyvus nei baltasis fosforas, tačiau jis gali užsidegti, jei įtrinamas. Štai kodėl jis naudojamas ant degtukų dėžutės šoninių paviršių. Kai patriname dantų krapštuką ant dėžutės paviršiaus, degtukai užsidega ir, savo ruožtu, užsidega ant dantų krapštuko galvos labai degios medžiagos.
Kai kuriose šalyse degtukas ant dantų krapštuko galvos uždedamas P pavidalu.4s3.
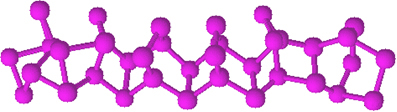
Raudonasis fosforas yra amorfiniai milteliai, tai yra, jie neturi kristalinės struktūros ir yra tamsiai raudonos spalvos, kaip parodyta žemiau:

Raudonojo fosforo milteliai.
* Vaizdo autorystė priklauso W. Oeleną ir ją galima rasti čia.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm
