Kovalentinis ryšys yra aukšto atomų sąveikos tipas elektronegatyvumas, tai yra didelis polinkis priimti elektronus. Cheminiai elementai, paprastai susiję su šio tipo jungtimis, yra šie:
Vandenilis (H)
Berilis (Be)
Boras (B)
Anglis (C)
Azotas (N)
Fosforas (P)
Deguonis (O)
Siera (S)
Fluoras (F)
Chloras (Cl)
Bromas (Br)
Jodas (I)
a) Dalyvių pobūdis
Cheminiai elementai, pasižymintys dideliu elektronegatyvumu ir dėl to jungiantys kovalentinius ryšius, yra šie:
Vandenilis
Ametalai
b) Kovalentinio ryšio atsiradimas
Priklausomai nuo kovalentiniame ryšyje dalyvaujančių cheminių elementų pobūdžio, tai gali įvykti taip:
Tarp dviejų vandenilio atomų;
Tarp nemetalo atomo ir vandenilio;
Tarp to paties cheminio elemento (nemetalo) atomų;
Tarp skirtingų cheminių elementų (abu nemetalų) atomų.
c) elektronų, kuriuos turi gauti kiekvienas atomas, skaičius
Elektronų, kuriuos kiekvienas nemetalo ar vandenilio atomas gauna sujungdamas, skaičius yra susijęs su okteto taisyklė.
Pagal okteto taisyklę, atomas yra stabilus, kai jis gauna aštuonis ar du elektronus (tik vandenilio atveju) valentiniame apvalkale. Pavyzdžiui, jei atomo valentiniame apvalkale yra penki elektronai, jis turi priimti tris elektronus, kad pasiektų stabilumą.
PASTABA: berilis ir boras yra išimtys iš okteto taisyklės, nes jie tampa atitinkamai stabilūs, o valentiniame apvalkale yra 4 ir 6 elektronai.
Elektronų skaičių valentiniame apvalkale galima lengvai nustatyti analizuojant cheminių elementų šeimą. Žemiau esančioje lentelėje turime elektronų skaičių valentiniame apvalkale, nurodant šeimą, kuriai priklauso elementas, ir elektronų skaičių, kurį jis turi gauti stabilumui pasiekti:

d) Kovalentinio ryšio principas
Kaip ir kovalentiniame ryšyje, visi susiję atomai turi polinkį privalomai priimti tarp jų bus dalijamasi elektronais, esančiais valentiniame apvalkale (toliausiai nuo branduolio).
Dalijimasis įvyksta, kai atomo valentinio apvalkalo elektronas tampa to paties elektroninio debesies, kuris supa kitą elektroną iš kito atomo valentinio apvalkalo, dalimi.
Pavyzdžiui, kiekvieno vandenilio atomo valentiniame apvalkale yra elektronas. Kai du elektronai tampa to paties debesies dalimi, kiekvienas vandenilis pradeda turėti du valentinius elektronus, tai yra stabilizuojasi.
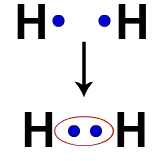
Dviejų vandenilio atomų elektronai užima tą patį elektronų debesį
e) Formulės, naudojamos kovalentiniam sujungimui
1ª) molekulinė formulė
Tai kiekvieno molekulės, sudarančios kovalentinius ryšius, atomų skaičiaus nurodymas.
Pavyzdys: H2O
Vandens molekulėje mes turime 2 vandenilio atomus ir 1 deguonies atomą.
2ª) struktūrinė formulė
Struktūrinė formulė rodo molekulės organizaciją, tai yra, rodo jungtis tarp atomų. Tam naudojami brūkšneliai, atspindintys kiekvieno atomo ryšį:
Paprasta (?): Rodo, kad atomas dalino tik vieną elektroną iš savo valentinio apvalkalo su kitu atomu ir atvirkščiai;
Dvigubas (?): Rodo, kad atomas dalino du elektronus iš savo valentinio apvalkalo su kitu atomu ir atvirkščiai;
Trigubas (≡): rodo, kad atomas pasidalino trimis elektronais iš savo valentinio apvalkalo su kitu atomu ir atvirkščiai.
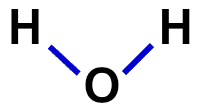
Vandens struktūrinė formulė
3ª) Lewiso elektroninė formulė
„Lewis“ elektroninė formulė taip pat atspindi molekulės organizaciją (elektroninė formulė), tačiau ja siekiama parodyti elektronų dalijimąsi atomuose.
Norėdami jį sukurti, pakanka gerbti organizaciją, pasiūlytą pagal struktūrinę formulę, ir pakeisti kiekvieną ryšių pėdsaką (viengubą, dvigubą ar trigubą) „dviem kamuoliukais“, kurie žymi elektronus.
Pavyzdžiui, vandens struktūrinėje formulėje mes turime du paprastus ryšius tarp vandenilių ir deguonies. Taigi tarp jų turėsime tik du rutulius, kuriuos riboja elipsė (kuri žymi elektroninį debesį).
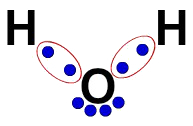
Lewiso elektroninė vandens formulė
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm

