Tekste „Medžiagų poliškumo ir tirpumo santykis“ matėte, kad tai paprastai ištirpsta polinės medžiagos tirpsta tirpikliuose, kurie taip pat yra poliniai, o nepolinės medžiagos - tirpikliuose nepolinis. Tačiau tai nėra taisyklė, kuri gali būti taikoma visais tirpumo atvejais.
Pavyzdžiui, cukrus ištirpsta vandenyje, bet aliejus - ne. Tiesa, kad vandens ir cukraus molekulės yra polinės, o aliejaus molekulės yra nepolinės, tačiau jos yra tarpmolekulinės jėgos tarp šių izoliuotų medžiagų molekulių ir viena kitos, kurios mums tai paaiškina faktas.

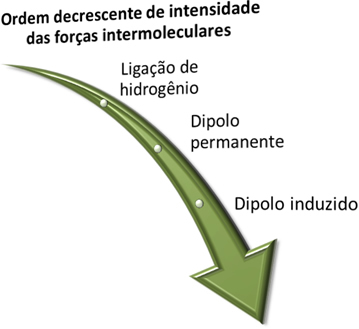
Prieš pamatydami, kokios yra šios jėgos, nepamirškite, kad intensyvumo stipresnis yra vandenilio ryšys, po kurio eina nuolatinė dipolio jėga, o silpniausia yra sukelta dipolio jėga.
Tiek vandens, tiek cukraus molekulės (sacharozė - C12H22O11), yra deguonies atomų, susietų su vandenilio atomais, formuodami ─ O ─ H grupes. Tai reiškia tarp vandens molekulių ir tarp cukraus molekulių gali būti tarpmolekulinės vandenilio jungčių sąveikos.
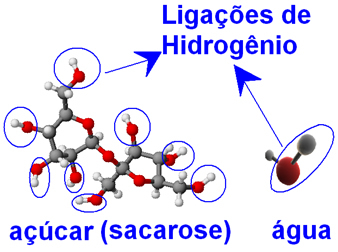
Štai kodėl vandens molekulės sugeba glaudžiai sujungtas cukraus molekules suvynioti kristalų pavidalu ir ištraukti jas, neleisdamos joms vėl prisijungti. Taigi cukrus puikiai tirpsta vandenyje, ir 100 g vandens, esant 20 ° C, galime ištirpinti iki 33 g jo.
Dabar aliejus ir vanduo nesimaišo. Tai nereiškia, kad aliejus netraukia vandens, nes tai, kad jis plinta vandens paviršiumi, o ne yra tokios formos sferinis, atskleidžia mums, kad ieško formos, kurioje didesnis kiekis aliejaus molekulių liečiasi su aliejaus molekulėmis. Vanduo.
Nesustokite dabar... Po reklamos yra daugiau;)
Tačiau potraukis tarp vandens molekulių yra daug didesnis (jungiantis vandeniliui) nei potraukis tarp naftos ir vandens molekulių. Todėl naftos molekulės negali nutraukti dviejų kaimyninių vandens molekulių ryšio.
Tai leidžia daryti išvadą, kad:
„Jei esama tarpmolekulinė jėga yra intensyvesnė už galimą naują sąveiką, tirpalas neištirpsta, lieka pirminis ryšys. Bet jei nauja sąveika bus stipresnė, ištirpęs tirpalas ištirps, sulaužydamas medžiagų tarpmolekulinius ryšius “.
Kitas pavyzdys, parodantis tarpmolekulinių jėgų svarbą medžiagų tirpumui, yra tada, kai turime jodo, vandens ir benzeno. Žemiau pateiktoje diagramoje yra tai, kad jodas gerai ištirpsta benzene ir šiek tiek tirpsta vandenyje, vandenyje ir benzene yra visiškai nesimaišo, o kai mes turime benzeno ir vandens mišinį ir tada įpilame jodo, jis ištirpsta tik benzenas:
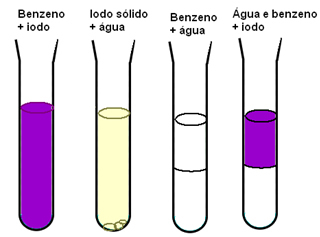
Benzenas ir jodas yra nepoliniai, juos maišyti lengviau nei vandenį, kuris yra poliarinis. Bet kas iš tikrųjų paaiškina, kas vyksta, yra tai, kad tarpmolekulinės sukeltos dipolinės jėgos, esančios tarp nepolinių molekulių, yra silpnos, palyginti su vandenilio jungtimis.
Todėl, kadangi esama vandens molekulių sąveika yra stipresnė už galimas naujas sąveika, vandenilio jungtys nėra nutrūkusios ir maišant benzeną ir Vanduo.
Nauja jodo ir benzeno molekulių sąveika yra intensyvesnė nei tarp šių izoliuotų medžiagų molekulių.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Tarpmolekulinės stiprybės ir medžiagų tirpumo ryšys“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/relacao-entre-forca-intermolecular-solubilidade-das-substancias.htm. Žiūrėta 2021 m. Birželio 27 d.

