At kovalentiniai ryšiai, taip pat vadinama molekulinės arba homopolinės jungtysyra tie, kurie atsiranda tarp atomų elektronegatyviniai elementai, tai yra, linkę priimti elektronus, užmezgdami ryšį dalijantis elektronais iš jų valentinių apvalkalų.
Kovalentinis ryšys gali atsirasti tarp šių elementų: vandenilis, nemetalai ir pusmetalai. Metalai niekada nedalyvauja tokio tipo rišime.
Panagrinėkime paprastą kovalentinio ryšio pavyzdį: vandenilį formuojančią jungtį (H2):
H + H → H2
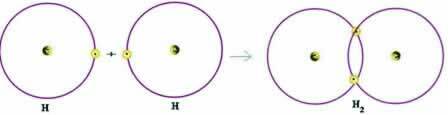
Atkreipkite dėmesį, kad abiem atomams reikėjo gauti elektroną, kad užbaigtų savo valentinį apvalkalą - pagal aštuoneto taisyklę - ir tokiu būdu išliktų stabilūs. Todėl jie dalijosi savo elektronais ir tokiu būdu abu turėjo du elektronus, turėjo pilną K apvalkalą ir įgijo tauriųjų dujų helio konfigūraciją.
Šis dalijimasis elektronais skiria šio tipo ryšį nuo joninio ryšio, kuriame vyksta elektronų perdavimas.
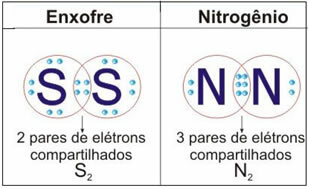
Toliau pateiktame paveikslėlyje rasite dar du šios bylos pavyzdžius:
Nesustokite dabar... Po reklamos yra daugiau;)
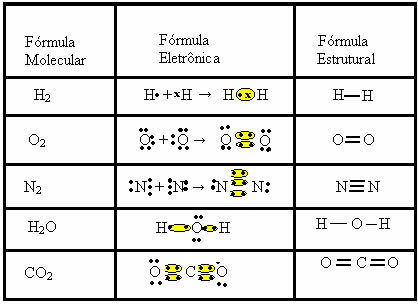
Šio tipo jungtyje susidaro molekulės, kurias galima pavaizduoti jų atitinkamomis jungtimis molekulinės formulės, tai yra paprasčiausias vaizdavimas, nurodantis, kiek kiekvieno elemento atomų yra molekulėje. Keletas molekulinių formulių pavyzdžių: H2, S2, O2, ne2, H2O, CO2ir kt.
Kovalentinį ryšį galima pavaizduoti dviem kitomis formulėmis:
- Elektroninė formulė arba Lewiso formulė: šioje formulėje taip pat atsiranda kiekvieno atomo valentinio apvalkalo elektronai ir elektroninių porų susidarymas. Šiuos elektronus simbolizuoja ženklai . arba x;
- Plokščioji struktūrinė formulė arba „Couper“ konstrukcinė formulė: rodo elementų nuorodas, kiekviena bendra pora atitinka brūkšnį. Jei tai tik brūkšnys, tai vadiname viena nuoroda; jei yra du, dvigubas ryšys; o jei yra trys brūkšniai, trigubas ryšys.
Atkreipkite dėmesį į kitus kovalentinių ryšių pavyzdžius, kuriuos rodo šios trys cheminės formulės:
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Kovalentinės obligacijos“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Žiūrėta 2021 m. Birželio 27 d.