Prancūzų chemikas Josephas Louisas Proustas (1754–1826) ėmėsi kruopščių eksperimentų, susijusių su tam tikrų reakcijų komponentų masėmis.
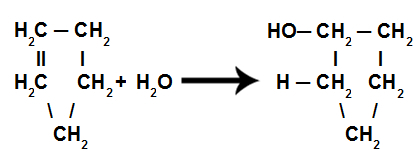
Pavyzdžiui, vandenį sudarantys elementai yra vandenilis ir deguonis. Proustas nustatė, kad šioje vandens formavimo reakcijoje vandenilis visada reagavo su deguonimi pastoviu ir apibrėžtu santykiu, kuris buvo atitinkamai 1: 8. Pažiūrėkite, kaip tai vyksta toliau:

Pastebėti, kad nesvarbu, kokia elementų masė būtų naudojama, dalis visada bus ta pati.
Proustas pažymėjo, kad taip buvo ne tik su vandeniu, bet ir su visomis kitomis medžiagomis.
15,06 g vario sulfido (CuS) susidaro, pavyzdžiui, reaguojant 10,00 g metalinio vario (Cu) su 5,06 g sieros (S). Taigi, jei padvigubinsime vario kiekį (kuris sieks 20,0 g) ir jei norime, kad visas varis sureaguotų, taip pat reikės padvigubinti sieros kiekį iki 10,12 g, iš viso susidarant 30,12 g sulfato sulfido.
Dabar, jei pridedama suma, kuri nėra proporcinga, perteklinė suma liks, ji nereaguos. Atkreipkite dėmesį į tai žemiau:
Nesustokite dabar... Po reklamos yra daugiau;)
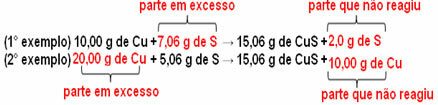
Pastebėti, kad reakcija vyksta tik pagal apibrėžtą proporciją. Todėl 1799 m. Proustas padarė išvadą, kad kai sujungiant kelias medžiagas susidaro junginys, tai visada daroma pagal apibrėžtą masės santykį.
Taigi jis sukūrė Įstatymą, kuris yra vadinamas Prousto įstatymas, Nuolatinių proporcijų dėsnis arba Apibrėžtų proporcijų dėsnis, kuris nurodomas taip:

Šis įstatymas ir Lavoisierio įstatymas (Masinės apsaugos įstatymas) yra įvardijami Svorio įstatymai, nes jie kalba masėmis susijusių medžiagų.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Prousto įstatymas arba pastovių proporcijų įstatymas“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Žiūrėta 2021 m. Birželio 27 d.