Kiekviena ląstelė yra įtaisas, kuriame vyksta savaiminė oksidacijos-redukcijos reakcija, generuojanti elektros srovę, kuri, savo ruožtu, naudojama tam, kad kai kurie įrenginiai veiktų.
Šie prietaisai gavo savo pavadinimą, nes pirmąją sukurtą bateriją išrado Alessandro 1800-aisiais metais ją suformavo cinko ir vario diskai, atskirti įmirkyta medvilne sūrymu. Šis rinkinys buvo padėtas tarpusavyje vienas ant kito, kaupiasi diskai ir suformuoti didelę koloną. Kaip buvo a baterija diskų, buvo pradėti vadinti tuo vardu.

Baterijos visada sudarytos iš dviejų elektrodų ir elektrolito. Teigiamas elektrodas vadinamas a katodas ir čia atsiranda reakcija sumažinimas. Neigiamas elektrodas yra anodas ir čia atsiranda reakcija oksidacija. Taip pat vadinamas elektrolitas druskos tiltas ir yra laidus jonams tirpalas.
Norėdami suprasti, kaip tai generuoja elektros srovę, žiūrėkite vienos iš pirmųjų baterijų - Danielio krūva, kuriame buvo talpa su vario sulfato tirpalu (CuSO4 (aq)) ir panardinta į tą tirpalą buvo vario plokštė. Kitame atskirame inde buvo cinko sulfato tirpalas (ZnSO
4 (aq)) ir panardintą cinko plokštelę. Du tirpalai buvo sujungti druskos tiltu, kuris buvo stiklinis vamzdelis su kalio sulfato tirpalu (K.2TIK4 (aq)) su stiklo vata galuose. Galiausiai abi plokštės buvo sujungtos išorine grandine su žibintu, kurio apšvietimas rodytų elektros srovės praėjimą: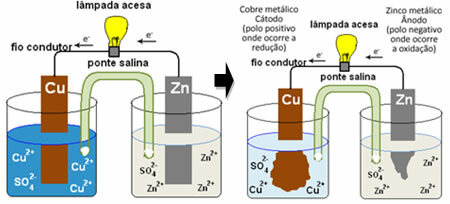
Atsitinka taip, kad cinkas turi didesnį polinkį oksiduotis, tai yra, prarasti elektronus, todėl metalinis mentės cinkas veikia kaip neigiamas elektrodas - anodas, kuriame vyksta oksidacija: Zns ↔ Zn2+(čia) + 2 ir-. Cinko prarasti elektronai išorine grandine pernešami į varį, sukuriant elektros srovę, kuri įjungia lempą. Tirpale esantys vario jonai priima elektronus (redukuoja) ir virsta metaliniu variu, kuris nusėda ant vario lakšto. Tai reiškia, kad tai yra teigiamas elektrodas, katodas, kuriame vyksta redukcija: Asilas2+(čia) + 2 ir- ↔ asilass.
Nesustokite dabar... Po reklamos yra daugiau;)
Šiandienos baterijos turi tą patį veikimo principą, kai vienas metalas per laidųjį tirpalą paaukoja elektronus kitam ir susidaro elektros srovė. Skirtumas tas, kad šiandien naudojamos baterijos yra sausos, nes jose kaip elektrolitas nenaudojamas skystas tirpalas, kaip būna Daniello akumuliatoriuje.
Šiandien yra labai įvairių baterijų, kurios parduodamos komerciškai. Tarp jų dažniausiai yra rūgštinės ląstelės (iš Leclanché) iralkalino baterijos.
Abiejų neigiamas elektrodas yra cinkas; kita vertus, kaip teigiamas polius, krūvos viduryje yra sumontuota grafito juosta, apsupta mangano dioksido (MnO2), anglies milteliai (C) ir drėgna pasta. Skirtumas tas, kad rūgščioje krūvoje šlapioje pastoje naudojamas amonio chloridas (NH).4Cl) ir cinko chloridas (ZnCl2) - rūgštinės druskos - be vandens (H2O). Šarminėje baterijoje naudojamas kalio hidroksidas (KOH), kuris yra pagrindas.

„Leclanché“ baterijos geriausiai tinka įrangai, kuriai reikalingas lengvas ir nuolatinis iškrovimas, pavyzdžiui, nuotolinio valdymo pultas, sieninis laikrodis, nešiojamas radijas ir žaislai. Kita vertus, šarminės baterijos turi 50–100% daugiau energijos nei įprasta tokio paties dydžio baterija. reikalauti greitesnio ir intensyvesnio atsisiuntimo, pavyzdžiui, radijo imtuvų, CD / DVD grotuvų, nešiojamų MP3, žibintuvėlių, skaitmeninių fotoaparatų ir kt.

Sužinokite daugiau apie tai, kokie elektrolitai ir elektrodai taip pat naudojami šiose ir kitose baterijose. apie tai, kokio tipo įrangai jie yra labiausiai rekomenduojami, skaitykite daugiau susijusių straipsnių paliegti.
Jennifer Fogaça
Baigė chemiją


