Atomo skaičius, kurį simbolizuoja raidė Z, atitinka protonų kiekį, esantį tam tikro cheminio elemento atomo branduolyje. Pavyzdžiui, vandenilio atominis skaičius yra 1, o tai reiškia, kad jo atominiame branduolyje yra tik 1 protonas.
Atomo skaičius paprastai rodomas šalia cheminio elemento indekso simbolio (apatiniame kairiajame kampe). Pavyzdys: 1H.
Esminėje būsenoje atomo skaičius yra lygus elektronų skaičiui, nes šioje būsenoje elementas yra todėl neutralus, teigiamų krūvių (protonų) kiekis turi būti lygus neigiamų krūvių (elektronų) kiekiui atomas.
Atominis skaičius yra svarbus, nes būtent jis periodinėje lentelėje nustato pagrindines elemento savybes ir savybes, taip pat jo elgesį ir vietą. Elementai yra išvardyti periodinėje lentelėje didėjančia atominio skaičiaus tvarka, kuri paprastai rodoma virš elemento, kaip parodyta žemiau. Atkreipkite dėmesį, kad pirmasis elementas yra vandenilis, H (Z = 1), paskui helis, He (Z = 2), tada ateina ličio, Li (Z = 3) ir kt.
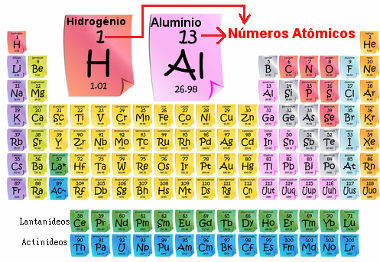
Atominis elementų skaičius periodinėje lentelėje
Mes netgi galime konceptualizuoti cheminį elementą kaip būtį „Atomų rinkinys, turintis tą patį atominį skaičių“. Taigi, kalbėdami, pavyzdžiui, apie cheminį elementą deguonis, kalbame apie atomus, kurių atominis skaičius yra 8. Žemiau mes turime periodinės lentelės 1 ir 2 periodų cheminių elementų atomus didėjančia atominio skaičiaus tvarka:

Cheminiai elementai iš periodinės lentelės 1 ir 2 periodų didėjančia atominio skaičiaus tvarka
Atominius skaičius iš pradžių apibrėžė anglų fizikas Henry Gwynas Jeffreysas Moseley (1887–1915) ir vykdydamas eksperimentus, susijusius su įvairių elementų bombardavimu chemikų, turinčių rentgeno spindulių, jis pastebėjo, kad rentgeno spindulių dažnio kvadratinė šaknis, gaunama išmetant atominį branduolį, buvo tiesiogiai proporcinga lentelės elemento atominiam skaičiui. Periodiškai. Tuo jis padarė išvadą, kad atomo skaičius yra susijęs su atomų savybėmis, nes jis atspindi teigiamų krūvių skaičių kiekvieno atomo branduolyje.
Cheminės jungtys neveikia atomų atomų skaičiaus, nes juose dalyvauja tik elektronai, esantys elektrosferoje. Tačiau branduolinėse reakcijose dalyvauja atomo branduolys, todėl yra įtrauktas ir atomo skaičius.
Pvz., Kai dalelės (daugiausia vidutinio sunkumo neutronai) bombarduojamos į sunkų, nestabilų atomo branduolį, tas branduolys yra suskaidytas ir atsiranda du mažesni atominiai branduoliai, tai yra su mažesniu protonų ir neutronų skaičiumi, išskiriant milžinišką kiekį energijos.
Kita vertus, branduolių sintezė yra priešingas procesas, kai susijungia du maži ir lengvi branduoliai, gaunantys didesnį ir stabilesnį branduolį, išleidžiantys dar didesnį energijos kiekį.
Taigi, kai tik įvyksta šios branduolinės reakcijos, atsiranda naujų cheminių elementų, nes pradinių elementų atominiai skaičiai skiriasi nuo galutinių elementų atominių skaičių. Pavyzdžiui, žemiau pamatykite, kad suskaidžius uraną-235, kurio atomo numeris 92, atsiranda baris (Z = 56), kriptonas (Z = 36) ir trys neutronai:

Urano-235 branduolio dalijimosi reakcija
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm
