Tu Angliavandeniliai yra sudaryti anglies (C) ir vandenilis (H). Anglies, kuri yra pagrindinis šių junginių elementas, lankstumas palaiko didžiulę struktūrų įvairovę Todėl kai kurios savybės, tokios kaip lydymosi temperatūra ir virimo temperatūra, gali skirtis tarp angliavandenilių ir kitų.
Jie dažniausiai yra molekulės apolarinis, su jėgas tarpmolekulinis sukeltas dipolio tipas ir tankis mažesnis nei nuo vandens. Šiuos junginius galima identifikuoti naudojant nomenklatūrą, kuri laikosi Tarptautinės grynosios ir taikomosios chemijos sąjungos (Iupac) nustatytų taisyklių.
Taip pat skaitykite: Anglis - vienas iš gausiausių Visatos elementų
Angliavandenilių savybės

Poliškumas: angliavandeniliai be heteroatomų yra apolarinis.
Tarpmolekulinės jėgos: jungtys tarp angliavandenilio molekulių yra tokio tipo sukeltas dipolis.
lydymosi temperatūra irverdamas: jie skiriasi pagal molekulės dydį, funkciją ir struktūrinę organizaciją.
fizinė būklė: normaliomis temperatūros ir slėgio sąlygomis angliavandeniliai, turintys keturis ar mažiau anglies atomų, yra dujinės būsenos. Tie, kuriuose yra nuo 5 iki 17 anglies, yra skystoje būsenoje, o angliavandeniliai, turintys daugiau nei 17 anglių, yra kietos medžiagos.
Tankis: yra mažesnis nei tankis vandens, ty mažiau nei 1,0 g / cm³.
Reaktingumas: alifatiniai ir nesotieji angliavandeniliai blogai reaguoja; nesotieji junginiai greičiausiai reaguoja su kitomis molekulėmis, o cikliniai angliavandeniliai, turintys iki penkių anglių, yra labai reaktyvūs.
Angliavandenilių klasifikacija
Angliavandeniliai gali būti klasifikuojamas pagal struktūrinę grandinės organizaciją ir įstaigos.Nesotumas yra dvigubo (-ių) arba trigubo ryšio tarp anglies junginių buvimas, yra pi tipo jungtys (π). jau šakos jie yra tarsi „šakos“, pritvirtintos prie didesnės angliavandenilių struktūros. Ciklinėse grandinėse taip pat gali būti šakų ir (arba) nesočiųjų - struktūrinė uždaros grandinės angliavandenilių organizacija sudaro daugiakampius, tokius kaip kvadratas, trikampis, heksanas.
Kalbant apie atomų išsidėstymą, angliavandenilis gali turėti įprastą arba šakotą grandinę.
→ C angliavandenilisnormali, tiesi arba tiesi linija: tas, kurio eilutė turi tik du galus.

→ C angliavandenilisnekenčia šakotas: tas, kurio grandinė turi daugiau nei du galus. Norint sužinoti, kur ir kokios šakos, svarbu teisingai pasirinkti pagrindinę grandinę. Pagrindinėje grandinėje turi būti visi nesotieji ir heteroatomai (jei yra), taip pat daugiausiai nuoseklių anglies junginių. Anglies junginiai, kurių nėra pagrindinėje grandinėje, yra šakos.
Pavyzdys:

Atsižvelgiant į jo „uždarymą“, angliavandenilis gali turėti uždarą, atvirą arba mišrią grandinę.
→ Grandininiai angliavandeniliais uždaras arba ciklinis: tie, kurių grandinės, kuriose atomai organizuojasi, sudaro ciklą, daugiakampį ar aromatinį žiedą (uždaras angliavandenilis, besikeičiantis nesočiųjų). Neturėkite laisvų galų, nebent yra šaka. Kiekviena daugiakampio viršūnė reiškia anglį ir atitinkamus vandenilį jungiančius agentus.
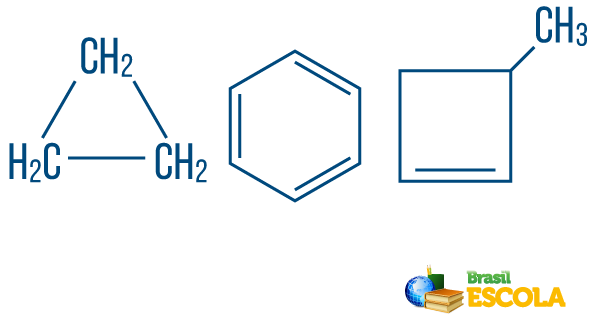
→ Atviros grandinės arba acikliniai angliavandeniliai: yra tie, kurių grandinės turi bent du galus.

→ Angliavandenilis iš mišraus tipo eilutė: yra sudarytas iš žiedo arba ciklinės grandinės, pritvirtintos prie tiesinės dalies; jis turi bent vieną galą.
Taip pat skaitykite: Aromatiniai angliavandeniliai - pavyzdžiai ir savybės
Angliavandenilių nomenklatūra
Kiekvienai angliavandenilių rūšiai taikoma „Iupac“ nustatyta pavadinimo taisyklė. Šių junginių nomenklatūra atliekama taip:
1-oji dalis: filialo (-ų) vieta ir pavadinimas (jei yra);
2-oji dalis: terminas galioja ciklas jei junginys yra uždara grandinė, bet jei ji yra alifatinė (atvira) grandinė, tai nebus būtina;
3 dalis: priešdėlis, nurodantis, kiek anglių yra pagrindinėje grandinėje;
4-oji dalis: vieta ir infix, nurodantys nesočiosios molekulės tipą;
5-oji dalis: angliavandeniliams tinkama priesaga „o“.
Jei molekulė yra atviros struktūros, be išsišakojimo, nomenklatūra prasidės 3 dalyje.
Šioje lentelėje pateikiama reikalinga angliavandenilių nomenklatūros informacija (priešdėlis, priešdėlis ir galūnė). O priešdėlis skiriasi atsižvelgiant į anglies kiekį; O infix, pagal nesočiųjų skaičių; tai priesaga“O " reiškia angliavandenilių tipo junginius.
Priešdėlis |
Infix |
Priesaga |
||
1 anglies |
susitiko |
Tik pavieniai skambučiai |
-an- |
-O |
2 anglies |
et- |
|||
3 anglies |
prop- |
1 dvigubas ryšys |
-en- |
|
4 anglies |
bet- |
|||
5 anglies |
pent- |
2 dvigubos obligacijos |
-dien- |
|
6 anglies |
šešiakampis |
|||
7 anglies |
hept- |
1 trigubas ryšys |
-į- |
|
8 anglies |
okt- |
|||
9 anglies |
ne |
2 trigubos nuorodos |
-diin- |
|
10 anglies |
dec- |
Pirmasis žingsnis atrandant organinio junginio nomenklatūrą yra nustatyti pagrindinę grandinę anglies, kurioje turi būti nesočiųjų ir kiek įmanoma daugiau nuoseklių anglių. Nustačius pagrindinę grandinę, anglies junginiai turi būti išvardyti - skaičiavimo pradžia nuo šono, esančio arčiausiai šakų ir nesočiųjų (jei yra). lokalizacija bus anglies, kurioje randama šaka arba nesotumas, skaičius. Kartais yra tik viena galima radikaliosios arba dvigubos arba trigubos jungties vieta, todėl jungiančiosios anglies vietos nomenklatūroje nurodyti nereikia.

šakų nomenklatūra bus pateiktas pagal anglies kiekį kiekviename, pridėjus nutraukimą linija arba ll. Kai yra daugiau nei viena šaka, naudojama abėcėlės tvarka.
Žr. Toliau pateiktus pavyzdžius:
→ 1 pavyzdys
CH3 - CH2 - CH3 → Propanas
1-oji dalis: priešdėlis „prop-“Rodo, kad grandinė turi tris anglis.
2-oji dalis: galūnė "-an-“Signalizuoja, kad molekulė užmezga tik tokio tipo jungtis sigma arba paprastas.
3 dalis: galūnė "-O“Būdinga angliavandeniliams.
→ 2 pavyzdys
CH2= CH-CH2-CH3 → But-1-enė
Angliavandeniliuose, kuriuose yra nesočiųjų, būtina suskaičiuoti ir surasti anglį, kurioje randama pora, o numeracija turi būti kuo mažesnė. Tam anglies kiekis turi prasidėti nuo pusės, artimiausios dvigubam ryšiui.
1-oji dalis: "bet- “ rodo, kad grandinėje yra keturi anglies junginiai.
2-oji dalis: „1-lt“ reiškia nesočią, esančią tarp anglies 1 ir 2.
3 dalis: „-O“ yra būdinga angliavandenilių priesaga.
→ 3 pavyzdys

1-oji dalis: "3-etilas" signalizuoja, kad ant anglies 2 yra dviejų anglies šakų.
2-oji dalis: „pent“ rodo penkių anglių buvimą pagrindinėje grandinėje.
3 dalis: "-an-" yra nesočiųjų grandinių antgalis (nėra dvigubų ar trigubų ryšių).
4-oji dalis: „-O“ yra būdinga angliavandenilių priesaga.
→ 4 pavyzdys
Grandinėms su daugiau nei viena šaka, padėkite radikalus į nomenklatūrą abėcėlės tvarka. Jei toje pačioje molekulėje yra šakų ir nesočiųjų, anglies anglis pagrindinėje grandinėje turėtų būti skaičiuojamas taip, kad vietos skaičių suma būtų kuo mažesnė.
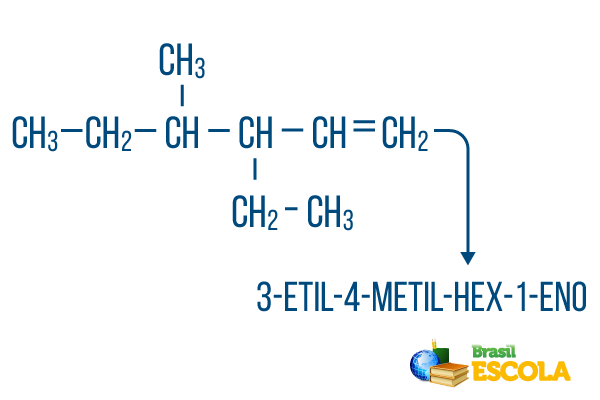
Pagrindinis grandinės anglies kiekis buvo skaičiuojamas iš kairės į dešinę, o nesočiųjų ir šakų vietos skaičių suma yra: 1 + 4 + 3 = 8. Jei anglies kiekis būtų rodomas iš dešinės į kairę, tai būtų sudėtinė nomenklatūra 4-etil-3-metil-5-enas, kurio vietų suma būtų: 4 + 3 + 5 = 12, kuri yra didesnė už kitą hipotezę, todėl ji neturėtų būti naudojama.
1-oji dalis: 3-etil-4-metilas nurodo radikalus abėcėlės tvarka ir jų atitinkamas vietas.
2-oji dalis: šešiakampis reiškia, kad pagrindinėje grandinėje yra 6 anglies junginiai.
3 dalis: 1-lt rodo dvigubą ryšį ant anglies 1.
4-oji dalis: „-O“ yra būdinga angliavandenilių priesaga.
→ 5 pavyzdys
Uždarytoms eilutėms galioja pavadinimo taisyklės, tačiau žodis ciklas prasideda junginio pavadinimas, nurodant, kad tai yra uždaras arba ciklinis angliavandenilis.
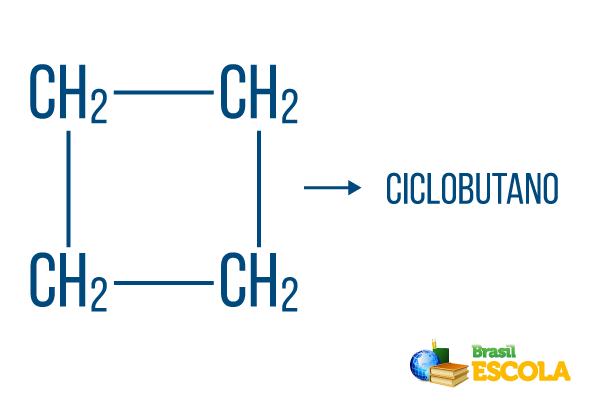
1-oji dalis: ciklas rodo, kad tai yra uždara eilutė.
2-oji dalis: -bet- žymi 4 anglies grandinių egzistavimą
3 dalis: -Oyra būdinga angliavandenilių priesaga.
Taip pat skaitykite: Anglies grandinių klasifikacija
Angliavandenilių rūšys
Angliavandeniliai gali būti skirstomi į alkanus, alkenus, alkinus ir alkadienus, kurie klasifikuojami kaip pagal grandinės (dvigubų (-ių) ar trigubų jungčių) nustatymą - ir ciklanus, kurie yra grandinės uždaryta.
→ Alkanai: yra angliavandeniliai, kurie neturi nesočiųjų. Bendra alkanų formulė yra CneH2n + 2, ir neomenklatūra jį sukūrė priešdėlis + an + O.
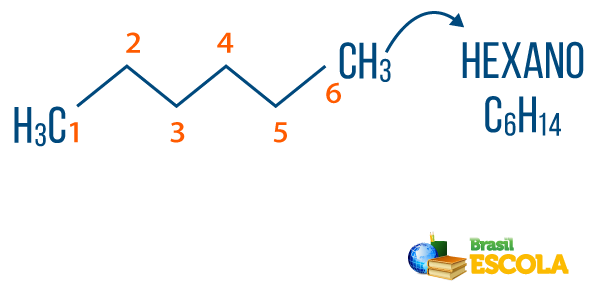
Tu alkanai galima rasti gamtoje, kaip dujos metanas (CH4), kurį išleidžia gyvūnai ir gamina skaidymo procesuose, taip pat naftos perdirbimo gamyklose ir naftos chemijos pramonėje. Junginiai kaip propanas (Ç3H7), butanas (Ç4H10), iš kurio susidaro mūsų virimo dujos (SND), ir oktaninis (Ç8H18), esančių automobilių degaluose, yra šalutiniai Nafta.

→ alkenai arba alkenai: yra anglies grandinės, turinčios nesočiųjų, dvigubą jungtį. Jo bendra formulė yra CneH2n, ir tavo neomenklatūra jį sukūrė Ppataisyti + lt + o.

O etileno dujos (Ç2H4), naudojama žemės ūkyje vaisių nokimui paspartinti, priklauso funkcijai alkenas. Junginys taip pat naudojamas žaliavų gamybai polietilenas, naudojami gaminant plastikinius indus.
→ Alkynes arba acetileno: angliavandeniliai su trigubu ryšiu. Jo bendra formulė yra CneH2n - 2. nomenklatūra jį sukūrė priešdėlis + į + o.

O acetilenas arba etinas (C.2H2) yra alkino funkcijos dujos, naudojamos suvirinimo siūlės ir metalo pjūviai. Šis junginys gali pasiekti iki 3000 ° C temperatūrą, o tai leidžia atlikti panardintų laivo dalių remontą.

→ alkadienai arba dienai: anglies grandinės su dviem nesočiosiomis, tai yra dviem dvigubomis jungtimis tarp anglies. Bendra šios funkcijos formulė yra C.neH2n - 2. Supraskite, kad tai yra ta pati formulė kaip ir alkinams, o tai reiškia, kad taip gali atsitikti izomerija tarp junginių (ta pati molekulinė formulė skirtingiems junginiams).
Alkadieno nomenklatūrą sudaro: Ppataisyti + dien + o.
Pavyzdys:

→ Uždaros grandinės angliavandeniliai: molekulės organizuojasi cikliškai, linkusios formuoti daugiakampį ir, lygiai taip pat, kaip ir atvirose grandinėse, gali atsirasti steigimų ir (arba) pasekmių. Ciklonai, ciklenai, ciklinai ir benzenai yra uždaros grandinės angliavandeniliai.
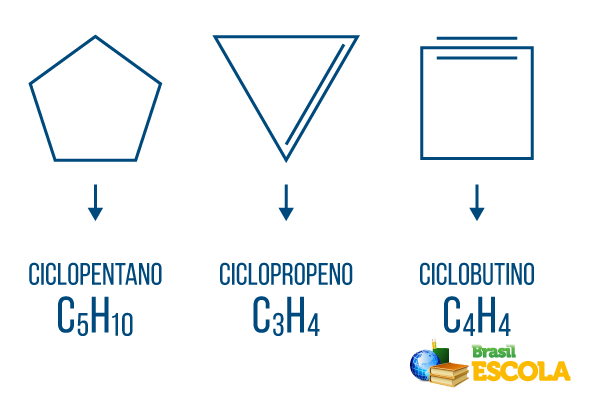
Ciklonai arba cikloalkanai: ciklinės grandinės, susidedančios tik iš viengubų jungčių. Jo bendra formulė yra CneH2n. Nomenklatūra: ciclo + priešdėlis + an + o.
Ciklai arba cikloalkenai: uždaros angliavandenilių grandinės su įmone. Jo bendra formulė yra CneH2n-2. Nomenklatūra: çiclo + priešdėlis + lt + O.
-
Ciklinai arba cikloalkinos: uždaros grandinės angliavandeniliai su dviem dvigubais ryšiais. Jo bendra formulė yra CneH2n-4. Nomenklatūra: çiclo + priešdėlis + į + o.
benzenai
Benzenas yra uždaros grandinės angliavandenilių, turinčių šeši angliai kur obligacijos skiriasi tarp vienos ir dvigubos. Šie junginiai yra toksiškas ir labai kancerogeniškas, naudojamas kaip organiniai tirpikliai cheminiuose procesuose.
Kad angliavandenilis būtų laikomas aromatiniu, turi būti bent vienas benzeno žiedas, kuri yra labai reaktyvi, todėl taikoma dviem ar daugiau pakaitalai, kurį čia pamatysime kaip pasekmes. Kai yra du susiejantys radikalai, kiekvienai pozicijų porai turėsime konkrečius pavadinimus.
Radialai ant 1,2 anglies benzeno → orto
Radikalai prie 1,3 anglies anglies anglies → įvartis
Radialai ant anglies1,4 benzolo → dėl
Aromatinio junginio anomenklatūra atliekama taip:
1-oji dalis: ligandų padėtis (orto, tikslas ar į).
2-oji dalis: radikalo arba radikalų, prijungtų prie benzeno, pavadinimas (metilas, etilas, propilas…). Radikalams suteiktas pavadinimas atitinka kitų angliavandenilių taisyklę.
- 3 dalis: -Bnuodai, kuris yra būdingas aromatinių angliavandenilių terminas.
Pavyzdžiai:
→ Orto-dimetil-benzenas

1-oji dalis: Orto- rodo, kad radikalai yra ant 1 ir 2 anglies.
2-oji dalis: -dimetil- reiškia du radikalus, turinčius vieną anglį.
3 dalis: -benzenas yra būdingas aromatinių angliavandenilių terminas.
→ Orto-etil-metil-benzenas
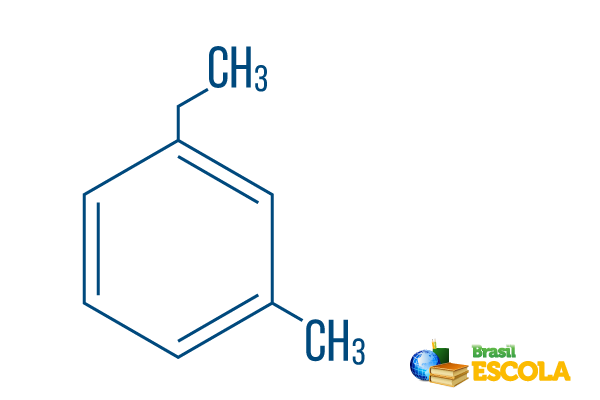
1-oji dalis: mOi- rodo, kad radikalai yra ant 1 ir 3 anglies.
2-oji dalis: etilmetil- reiškia anglies kiekį kiekviename radikale, esantį etilas dviejų anglies šakų ir metilas išsišakojusios viena anglimi - dedamos į nomenklatūrą abėcėlės tvarka.
3 dalis: -benzenas yra būdingas aromatinių angliavandenilių terminas.
→ para-dietil-benzenas
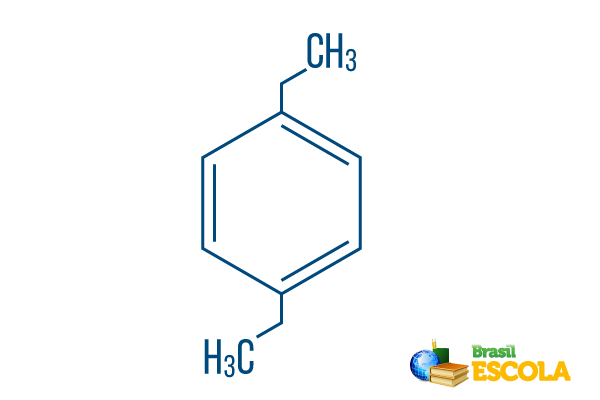
1-oji dalis: Pplūgas rodo, kad radikalai yra benzeno 1 ir 4 anglyse.
2-oji dalis: -dietilas- pateikia du tokio tipo radikalus etilas, tai yra dvi šakos su dviem anglimis.
3 dalis: -benzenas yra būdingas aromatinių angliavandenilių terminas.
Taip pat skaitykite:Benzolo struktūros atradimas
sprendė pratimus
(Unesp) - Oktanas yra viena iš pagrindinių benzino, kuris yra angliavandenilių mišinys, sudedamųjų dalių. Oktano molekulinė formulė yra:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Atsakymas: a raidė. Analizuojant sudėtinę nomenklatūrą oktanas, tai alkanas, tai yra molekulė, susidedanti tik iš viengubų jungčių. Jei bendra alkanų formulė yra CneH2n + 2, pakeisdami „n“ aštuoniais, tai yra anglies kiekis pagrindinėje grandinėje - ir šiuo atveju unikalus, turėsime, kad oktano molekulinė formulė yra C8H18.
(UFSCar-SP) - Apsvarstykite šiuos teiginius apie angliavandenilius.
I) Angliavandeniliai yra organiniai junginiai, susidedantys tik iš anglies ir vandenilio.
II) Alkenais vadinami tik tiesiosios grandinės nesotieji angliavandeniliai.
III) Cikloalkanai yra sotieji alifatiniai angliavandeniliai, kurių bendra formulė CnH2n.
IV) Aromatiniai angliavandeniliai: brombenzenas, p-nitrotoluenas ir naftalenas.
Šie teiginiai yra teisingi:
a) tik aš ir III.
b) tik I, III ir IV.
c) tik II ir III.
d) tik III ir IV.
e) tik I, II ir IV.
Atsakymas: Laiškas a).
II - Alkenai yra junginiai, turintys dvigubą jungtį, tai yra, nesotieji, tačiau jų grandinėje jie gali turėti pasekmes, nebūdami išskirtinai tiesiniai.
IV - Brometobenzenas ir p-nitrotolueno junginiai priklauso kitiems organinės funkcijos.
pateikė Laysa Bernardes
Chemijos mokytoja
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm