Fermentai yra biologiniai katalizatoriai, atsakingi už tam tikros cheminės reakcijos greičio padidėjimą. Fermentai paprastai yra baltymai, bet yra ir tokių ribonukleino rūgštys kurie veikia kaip fermentai, vadinami ribozimais.
Norėdami pagreitinti reakciją, fermentai turi prisijungti prie reagentų, kurie yra žinomi kaip substratai. Manoma, kad ilgą laiką ši sąsaja atsirado labai griežtai, tai vadinama rakto užraktu. šiuo metu, Tačiau priimamas modelis, žinomas kaip sukeltas pritaikymas., kuris daro prielaidą, kad substratui patekus į aktyvią vietą, fermento pavidalu įvyksta nedideli pokyčiai.
Taip pat skaitykite: Kas yra medžiagų apykaita?
Kas yra fermentai?
Fermentai yra biomolekulės, kurios veikia kaip katalizatoriai, tai yra jos yra medžiagos, galinčios pagreitinti greitį cheminės reakcijos kurie pasitaiko gyvose būtybėse jų nevartojant šių reakcijų metu. Be fermentų veikimo kai kurios reakcijos būtų labai lėtos, o tai pakenktų medžiagų apykaitai. Fermentai selektyviai pagreitina reakcijas, todėl yra labai specifiniai katalizatoriai.
Fermentai sugeba pagreitinti reakciją, sumažindami aktyvacijos energiją, tai yra sumažina energijos kiekį, kuris turi būti pridėtas, kad reakcija prasidėtų.
[publikacija_omnia]
Ar kiekvienas fermentas yra baltymas?
Nors jie dažnai apibrėžiami kaip baltyminio pobūdžio biologiniai katalizatoriai, ne kiekvienas fermentas yra baltymas. Yra keletas RNR, kurios veikia kaip fermentai, vadinamos ribozimais. Tačiau dauguma fermentų yra baltymai, todėl susidaro amino rūgštys. Šių biomolekulių aminorūgščių sudėtis apibrėžia trimatę struktūrą, kurią ji įgis.
Taip pat skaitykite: Kaip veikia katalizatoriai?
Fermentų-substratų kompleksas
Jis vadinamas reagento substratu, kuriame veikia fermentas. Fermentui prisijungus prie jo substrato, susidaro kompleksas fermentas-substratas. Šis susiejimas vyksta konkrečiame regione, vadinamame aktyvia vieta.
Kai mes kalbame apie baltymų pagrindu pagamintus fermentus, aktyvioji vieta atitinka tik keletą amino rūgščių, o likusioji molekulės dalis yra atsakinga už aktyvios vietos konfigūracijos nustatymą. Aktyvios vietos forma, taip pat substrato forma yra susijusios su fermento specifiškumu, nes jos turi būti viena kitą papildančios.
Rakto užrakto modelis
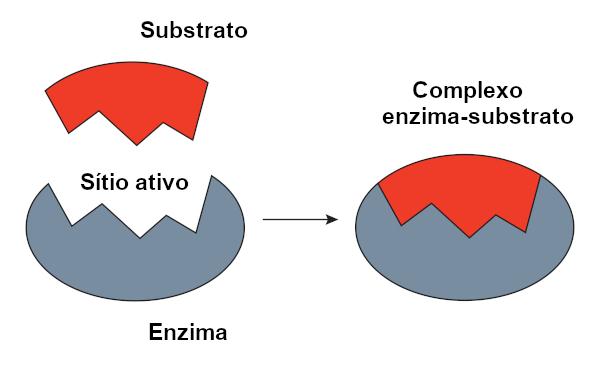
O rakto užrakto modelis, kurį pasiūlė Emilis Fischeris, plačiai naudojama paaiškinti fermento ir substrato sąveiką. Pagal šį modelį yra griežtas fermento ir substrato papildomumas, kaip ir raktas bei spyna. Aktyvi fermento vieta turėtų papildomą substrato formą, kuri puikiai tiktų. Todėl kitos molekulės negalėtų patekti į šią vietą, o tai garantuotų fermento specifiškumą. Kaip raktas atveria tik spyną, fermentas prisijungia tik prie substrato. Tačiau šiandien mes žinome, kad tai modelis nėra teisingas, nes fermentai nėra standžios struktūros, kaip manyta anksčiau.
Sukeltas montavimo modelis
Šiuo metu labiausiai priimtinas modelis paaiškinti ryšį tarp fermento ir jo substrato yra vienas iš spragtelėk sukeltas, iš pradžių pasiūlė Koshlandas ir kt. Aktyvi svetainė ir substratas neveikia griežtai kaip raktas ir spyna. Tyrimai rodo, kad substratui patekus į aktyvią vietą, fermentas šiek tiek modifikuojamas, o tai palankiai tinka aktyviosios vietos ir substrato tinkamumui. Norėdami geriau suprasti šį modelį, galime galvoti apie fermento ir substrato sąveiką kaip rankos paspaudimą, kuris tampa tvirtesnis po pirmo kontakto.
Kofaktoriai
Daugumai fermentų kataliziniam veiksmui atlikti reikalingos pagalbinės molekulės, vadinamos kofaktoriais. Kofaktoriai gali būti nuolat pritvirtinti prie fermento arba silpnai ir grįžtamai pritvirtinti prie substrato. Jie taip pat gali būti neorganinis arba organinis. Kai kofaktoriai yra organinės molekulės, jie vadinami kofermentai.
Kai kurie vitaminai veikia kaip kofermentai, taip yra, pavyzdžiui, riboflavino, dar vadinamo vitaminu B2. Kaip neorganinių kofaktorių pavyzdžius galime paminėti geležį ir cinką jų joninės formos pavidalu.
Taip pat skaitykite: B komplekso vitaminai - grupė vitaminų, kurie paprastai veikia kaip kofermentai
Fermentų klasifikacija
Fermentus galima suskirstyti į šešios grupės, kaip kriterijų naudojant jų katalizuojamos reakcijos tipą.
Oksidoreduktazės: fermentai, susiję su oksirassumažinimas.
Transferazės: katalizuoti grupių perkėlimą iš vieno junginio į kitą.
Hidrolazės: katalizuoti hidrolizės reakcijas.
Liases: veikti pridedant grupes prie dvigubų jungčių arba pašalinant grupes, sudarančias dvigubą jungtį.
Izomerazės: katalizuoti izomerizacijos reakcijas.
Nuorodos: fermentai, sukeliantys molekulės skilimą ATP, panaudojant šioje reakcijoje išsiskyrusią energiją naujiems junginiams formuoti.
Nesustokite dabar... Po reklamos yra daugiau;)
Veiksniai, reguliuojantys fermentų aktyvumą
Fermento aktyvumui įtakos turi veiksniai, kurių pagrindiniai yra temperatūra ir pH. Temperatūra paprastai atlieka teigiamą vaidmenį cheminėse reakcijose, didindama fermentinės reakcijos greitį. Tačiau kai temperatūra padidėja virš optimalių sąlygų, reakcijos greitis žymiai sumažėja. Taip yra todėl, kad pastebimas baltymų denatūravimas. Daugelio žmogaus fermentų optimali temperatūra yra nuo 35 iki 40 ºC. Be temperatūros, pH tai taip pat turi įtakos fermentiniam aktyvumui, taip pat yra optimali vertė. Daugumai fermentų optimali pH vertė yra nuo 6 iki 8.
Autorius Vanessa Sardinha dos Santos
Biologijos mokytoja