formavimosi entalpija, taip pat vadinama standartinė formavimo entalpijaarba standartinė formavimosi šiluma, apskaičiuojama šiluma, išsiskirianti arba absorbuota susidarant 1 moliui medžiagos iš paprastų medžiagų, esant standartinei būklei.
Neįmanoma apskaičiuoti absoliučios kiekvienos medžiagos entalpijų vertės, tačiau kalorimetru galima apskaičiuoti reakcijos metu atsirandantį entalpijos pokytį.
Būtina tai prisiminti buvo susitarta dėl standartinės būsenos paprastų medžiagų entalpijos vertės, lygios nuliui. Taigi, jei norime sužinoti, kas yra medžiagos susidarymo entalpija, mums reikia žinoti tik jos susidarymo reakcijos iš paprastų medžiagų entalpijos vertę.
Pavyzdžiui, norime rasti 18 gramų vandens entalpiją, kuri atitinka 1 mol, nes jos molinė masė yra 18 g / mol. Norėdami tai padaryti, pirmiausia reikia reakcijos, kad susidarytų vanduo iš paprastų medžiagų, kaip parodyta žemiau:
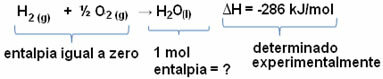
Atkreipkite dėmesį, kad šioje reakcijoje įvykusio entalpijos pokyčio vertė eksperimentiškai buvo nustatyta kalorimetru ir yra lygi -286 kJ / mol.
Formulė, kuri apskaičiuoja šį entalpijos pokytį (ΔH) yra:
ΔH = HProduktai - HReagentai
Taigi, kadangi mes jau žinome ΔH vertę ir kad reagentų entalpija yra lygi nuliui (nes tai yra paprastos medžiagos standartinėje būsenoje), galime daryti išvadą kad 1 molio vandens entalpijos vertė yra lygi susidarymo reakcijos entalpijos pokyčiui, nes tai yra vienintelis tos reakcijos produktas, kaip parodyta žemyn:
ΔH = HProduktai - HReagentai
-286 kJ / mol = HH2O - (HH2 + H1/2 O2)
-286 kJ / mol = HH2O - 0
HH2O = - 286 kJ / mol
Šio tipo entalpija, pasiekta paprastų medžiagų entalpija standartinėje būsenoje, yra standartinė formavimo entalpija (ΔH0).
Dabar yra daugybė medžiagų, kurios nesusidaro tiesiogiai per vieną reakciją, pavyzdžiui, vanduo. Tokiais atvejais susidarymo entalpiją galima apskaičiuoti pagal reakcijos entalpijos kitimą.
Pavyzdžiui, NH4Cl susidaro tokia reakcija:
NH3 + HCl → NH4Cl ΔH = -176 kJ / mol
Atkreipkite dėmesį, kad nė vienas iš reaguojančių medžiagų nėra paprasta medžiaga, todėl negalime jiems priskirti nulio entalpijos. Turime žinoti kiekvieno reagento susidarymo entalpijas, nes jos susidaro reaguojant tarp paprastų medžiagų:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92,4 kJ / mol
Susumavus šias dvi entalpijas, gauname reaguojančių medžiagų entalpijos vertę ir galime rasti NH entalpiją4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ / mol)
HR = -138,4 kJ / mol
Formulėje pakeičiant:
ΔH = HProduktai - HReagentai
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ / mol
Šiuo atveju mes tiesiogiai susumavome reagento susidarymo entalpijų reikšmes, nes reakcijos santykis buvo tik 1 mol. Tačiau jei kitose reakcijose apgamų kiekis skiriasi, pirmiausia reikės padauginti reagento susidarymo entalpiją iš apgamų skaičiaus.
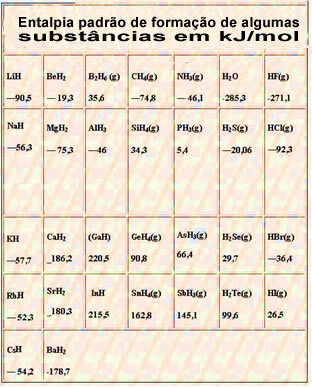
Žemiau yra lentelė su kai kurių medžiagų susidarymo standartine entalpija esant 25 ° C ir 1 atm:
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm
