Kaip parodyta tekstuose "Cheminių elementų elektromagnetinis spektras"ir"Emisijos ir absorbcijos spektrai bei Kirchhoffo dėsniai“, Kiekvieno cheminio elemento nevienodos emisijos spektrai yra skirtingi.

Taigi, žemiau mes turime skirtingus kai kurių iš šių elementų spektrus:

Taigi danų fizikas Nielsas Böhras (1885-1962) suprato, kad tai gali būti susiję su kiekvieno iš šių elementų atomo struktūra. Taigi jis pasiūlė atominį modelį, kuris papildytų Rutherfordo modelį, tačiau daugiausia dėmesio skyrė aplinkinių elektronų elgsenai atomo branduolyje.
Kiek anksčiau Maxas Planckas (1858–1947) pasiūlė teoriją, kad elektronai yra kiekybiškai, ta prasme, kad jie išskiria ir sugeria tam tikrus energijos kiekius, tarsi tai būtų maži energijos pakeliai, kurį jis pavadino kiek (kvantinė, vienaskaita).
Taigi Böhras pasiūlė: kadangi kiekvienas elementas turi skirtingą spektrą, kiekvieno elemento atome elektronai yra pastovūs ir skiriasi nuo kiekvieno elemento.
Kiekvienas elektronas gali likti tik tam tikroje konkrečioje orbitoje, nes kiekvienoje iš šių orbitų elektronas turi pastovią, tiksliai apibrėžtą ir būdingą energiją. Elektronas gali užimti tik tuos energijos lygius, kuriems jis turi atitinkamą energiją.
Spektrai yra pertraukiami, nes elektronai yra kiekybiniai.
Elektronas gali pakeisti lygius tik tada, jei sugeria energiją. Pavyzdžiui, degindami natrio druską Bunseno degiklyje, jūs tiekiate energiją elektronams. Absorbuodamas energijos kvantą, elektronas peršoka į kitą energingesnį lygį, likdamas sužadintoje būsenoje. Tačiau pagrindinė būsena yra stabilesnė, todėl šis elektronas skleidžia sugertą energiją ir grįžta į pradinę orbitą. Jis skleidžia šią energiją elektromagnetinių bangų pavidalu, kurias galima vizualizuoti šviesos pavidalu. Natrio atveju ši šviesa yra intensyviai geltonos spalvos. Taigi, kai šios bangos praeina per prizmę, gaunamas nenutrūkstamas natrio spektras.
Taigi Böhrui, kiekviena šviesos linija, pasirodžiusi nenutrūkstamame elementų spektre, nurodė energiją, išsiskyrusį, kai elektronas grįžo iš vieno išorinio lygio į arčiau branduolio.
Toliau pateiktas paveikslėlis padeda geriau suprasti šią problemą:
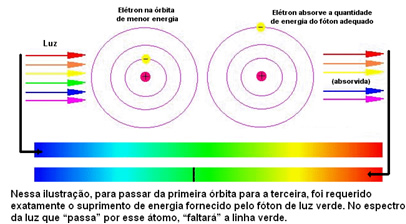
Kadangi kiekvieno elemento atomams leidžiamos tik tam tikros energijos vertės, atitinkančios energijos sluoksnius, kiekvienam elementui yra skirtingas spektras.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
