Atsiskyrimas pagrindai tai yra fizinis procesas kuris įvyksta su šia svarbia neorganinių medžiagų grupe, kai jos ištirpsta vandenyje, arba kai jie praeina sintezės procesą (perėjimas iš kietosios būsenos į skystąją būseną per šildymas).
Apskritai, reiškinys bazės atsiribojimas tai yra katijonų ir anijonų, iš kurių susidaro, išsiskyrimas joninis junginys, kuri šiuo atveju yra pagrindas. Taigi, per bazės atsiribojimas, išleidimas jonai kurios jau egzistuoja junginyje, tai yra nesusidaro nauji jonai.
Pagrindą sudaro bet kuris metalas (X), kuris yra junginio katijonas, arba amonio katijonas (NH grupė4+), sujungtą su hidroksido anijonu (atstovaujamu OH grupės), kaip parodyta toliau:
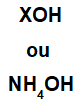
Bendrieji pagrindinės formulės vaizdai
forma atstovauti bazės atsiribojimas tai daroma per lygtį, kurioje reagente turime pagrindą, o produktuose - jonus (katijonus ir anijonus). Skirtumas yra tai, kaip vyksta atsiribojimas:
Pagrindo ištirpimas vandenyje:
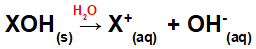
Lygtis, vaizduojanti bazės disociaciją vandeninėje terpėje
Atsiribojimas pagal bazinį susijungimą:
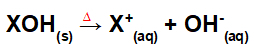
Lygtis, vaizduojanti bazės disociaciją sintezės proceso metu
Analizuodami anksčiau pateiktas bendras lygtis, mes patikriname, ar visose jose visada bus pagrindas, katijonas (kuris yra metalo arba NH grupė4+) ir anijonas (OH-). Bet ar jie visi tokie? Ar nėra jokio skirtumo tarp jų? Į pirmąjį klausimą atsakoma neigiamai, o į antrąjį - taip.
Nesustokite dabar... Po reklamos yra daugiau;)
Kai mes atliekame atsiribojimas nuo bazės, pirmiausia būtina išanalizuoti pagrindinę formulę, nes pagal ją galime nustatyti katijonas ir hidroksido anijonų molinis kiekis, nes katijonų molinis kiekis yra standartinis (visada 1 mol).
Verta prisiminti, kad OH grupių kiekis, esantis bazinėje formulėje, lemia katijono krūvį ir hidroksido anijono kiekį molyje disociacijos metu.
Pažvelkime į aliuminio hidroksido pavyzdžius [Al (OH)3] ir aukso hidroksidas (AuOH). Aliuminio pagrindo formulėje yra trys OH grupės, o aukso pagrindo formulėje - tik viena OH grupė. Taigi, atsiribodami nuo šių bazių, turime:
Al (OH) atsiribojimas3:
Kadangi šioje bazėje formulėje yra trys OH grupės, katijono krūvis bus +3, o anijonų kiekis moliais yra lygus 3 mol, kaip matome šioje lygtyje:
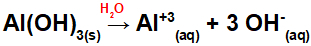
Aliuminio pagrindo disociacijos lygtis vandeninėje terpėje
Atsiribojimas nuo AuOH:
Kadangi šioje bazėje formulėje yra OH grupė, katijono krūvis bus +1, o anijonų kiekis moliuose yra lygus 1 mol, kaip matome šioje lygtyje:
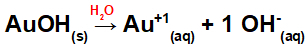
Bazės disociacijos su auksu vandeninėje terpėje lygtis
Mano. Diogo Lopes Dias
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
DIENOS, Diogo Lopes. „Kas yra bazinis atsiribojimas?“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm. Žiūrėta 2021 m. Birželio 27 d.
Chemija

Atsiribojimas ir jonizavimas, italų mokslininkas Volta, elektros srovė, švedų fizinis chemikas Svantas Augustas Arrheniusas, teorija Arrhenius, teigiami jonai, katijonai, neigiami jonai, anijonai, kaustinė soda, valgomoji druska, polinės molekulės, disociacija joninis,

