Mokslininkas Friedrichas Kohlrauschas (1840–1910) pirmasis pasiūlė, kad grynas vanduo praleistų elektrą, nors ir nedideliu mastu. Taip yra todėl, kad vanduo elgiasi amfoteriškai; tai yra, tam tikrais atvejais jis veikia kaip rūgštis ir dovanoja protonus (H+); o kituose jis elgiasi kaip bazė, priimdamas protonus.
Tai reiškia, kad vanduo atlieka savo jonizaciją pagal toliau pateiktą cheminę lygtį:
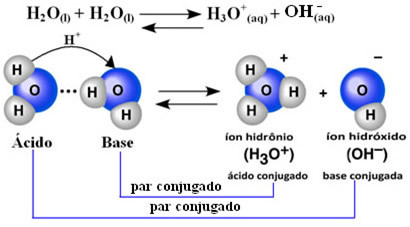
Šis procesas vadinamas vandens autoionizacija ir tai vyksta labai mažu mastu, tai yra vanduo yra labai silpnas elektrolitas, turintis mažas jonizacijos laipsnio vertes ir jonizacijos pusiausvyros konstanta (ç). Būtent todėl vanduo turi tokį žemą laidumą.
Kad gautumėte idėją, esant 25 ° C aplinkos temperatūrai galima nustatyti, kad hidroksido ir hidronio jonų koncentracijos, susidariusios gryname vandenyje savaime jonizuojantis, yra lygios 1. 10-7 mol. L-1. Tai reiškia, kad iš milijardo vandens molekulių jonizuoja tik dvi.
Vadinama vandens jonų pusiausvyros konstanta çvandens disociacijos konstanta,autoprotolizės konstanta
arba joninis vandens produktas.Ši konstanta vaizduojama K.w, nes w nurodo žodį vandens, kas angliškai reiškia vandenį.Nesustokite dabar... Po reklamos yra daugiau;)
Jo skaičiavimas atliekamas taip pat, kaip ir kitos pusiausvyros konstantos, atsimenant tai, kaip teigiama tekste „ Balansas Kc ir Kp “, šiuo atveju išraiškoje bus rodomi tik produktai, nes skystas vanduo turi tą patį aktyvumą iki 1. Grynos skystos ar kietos medžiagos neįtraukiamos į disociacijos nuolatinę išraišką, nes jos nesikeičia. Dedami tik vandeniniai ir dujiniai tirpalai. Taigi mes turime:
K.w = [H3O+]. [Oi-]
K.w = (1. 10-7). (1. 10-7)
K.w = 10-14
Kaip ir kitose pusiausvyros konstantose, Geraiw jis keičiasi tik keičiantis temperatūrai. Didėjant vandens temperatūrai, didėja ir jo jonizacija, o tai reiškia, kad vandens savaiminė jonizacija yra endoterminis procesas, tai yra, sugeria šilumą.
Tai matyti iš joninio vandens produkto (Kw), pateiktas toliau pateiktoje lentelėje esant skirtingoms temperatūroms:
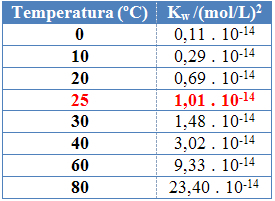
Joninis vandens produktas visada turės fiksuotą vertę kiekvienoje temperatūroje, tiek gryname vandenyje, tiek tirpale. Net jei tirpale yra H jonų koncentracijos3O+ o o- skiriasi, produktas tarp jų išliks pastovus.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Joninio vandens produktas (kW)“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Žiūrėta 2021 m. Birželio 28 d.