Prieš pristatant molinė masė ir molinis skaičius, pažiūrėkime į keletą svarbių apibrėžimų šiame kontekste:
→ Molinis terminas
Molaras kilęs iš žodžio molekulė, bet kas tiksliai yra molekulė? Tai yra atomų rinkinys, sujungtas cheminėmis jungtimis.
→ Molekulinė masė (MM)
Galima apskaičiuoti molekulės masę pagal kiekvieno atomo, sudarančio atitinkamą molekulę, atominių masių sumą. Rezultatas vadinamas molekuline mase (MM).
Kokia būtų vandenilio sulfido (H2S) pavyzdžiui?
Pirmiausia turite žinoti, kas yra atominė masė kiekvieno atomo, kurį pateikia periodinė lentelė elementai.
Vandenilio (H) atominė masė = 1 a.m.u. (vienetas atominei masei)
Atominė sieros masė (S) = 32,1 a.u.u.
Molekulinė masė yra atomų atominių masių suma.
Pastaba: H molekulės vandenilis2S koeficientas yra 2, todėl jo masę reikia padauginti iš 2. Skaičiuojama:
H molekulinė masė2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Molinė masė ir apgamų skaičius
Nesustokite dabar... Po reklamos yra daugiau;)
Molinė masė, taip pat apgamų skaičius, yra susiję su „Avogadro“ pastovioji (6,02 x 1023) pagal šią koncepciją:
1 molyje esančių elementų skaičius atitinka Avogadro konstantą, kurios vertė yra 6,02 x 1023 mol-1.''
Todėl molinė masė yra 6,02 x 10 masė23 cheminių vienetų ir išreiškiamas g / mol.
Minčių žemėlapis - Mol
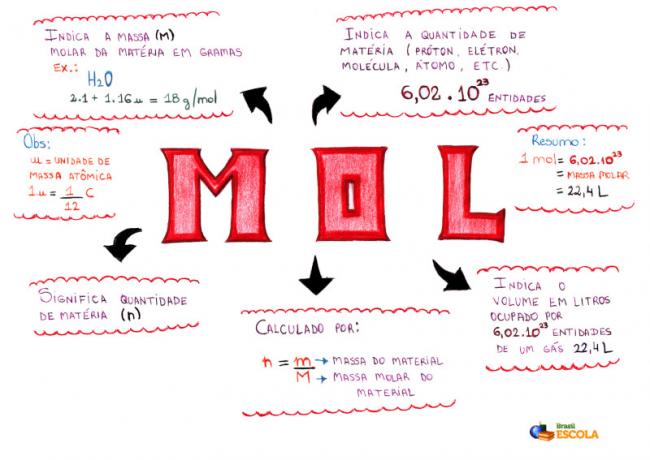
* Norėdami atsisiųsti minčių žemėlapį, Paspauskite čia!
Pavyzdys: H2s
Molekulinė masė = 34,1 u
Molinė masė (M) = 34,1 g / mol
Tai reiškia, kad esant 34,1 g / mol vandenilio sulfido, turime 6,02 x 1023 molekulės arba 1 molis vandenilio sulfido molekulių.
Išvada
Molekulinė masė ir molinė masė turi tas pačias reikšmes, skiriasi matavimo vienetas. Molinė masė yra susijusi su apgamų skaičiumi, kurį nurodo Avogadro konstantos.
* Mano minčių žemėlapis. Diogo Lopes
Autorius Líria Alves
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
SOUZA, Líria Alves de. "Molinė masė ir apgamų skaičius"; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Žiūrėta 2021 m. Birželio 27 d.


