Tekste "Magminė elektrolizė“, Buvo paaiškinta, kad šis procesas vyksta, kai elektros srovė praeina išlydytoje medžiagoje (skystoje būsenoje), be tokiu būdu katijonas gauna elektronus, o anijonas - elektronus, todėl abiejų elektros krūvis yra lygus nuliui ir energijai sukaupta.
Norėdami geriau suprasti, kaip vyksta magminė elektrolizė, apsvarstykime vieną iš svarbiausių tokio tipo procesų pavyzdžių - natrio chlorido arba valgomosios druskos (NaCl) elektrolizę.
Natrio chloridas gamtoje susidaro perduodant elektroną iš natrio (Na) į chlorą (Cl), kaip nurodyta toliau pateiktoje reakcijoje:
2Na (s) + 1Cl2(g) → 2NaCl (s)

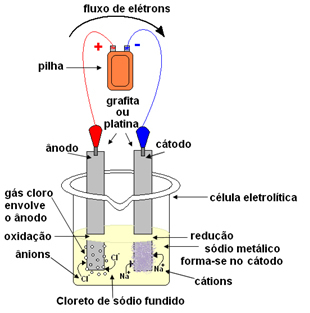
Šis procesas yra savaiminis, tačiau atvirkštinis šios reakcijos procesas nėra savaiminis, ty chloro dujų (Cl2(g) - paveikslas žemiau) ir metalinis natris (Na (-ai)) gamtoje nevyksta. Jei norime, kad tai įvyktų, turėsime pradėti procesą.
Tai galima padaryti magminę elektrolizę. Druska pašildoma iki aukštesnės nei 800,4 ° C temperatūros, kuri yra jos lydymosi temperatūra; ir tokiu būdu jis susilieja, pereidamas iš kieto į skystą. Šioje fizinėje būsenoje jūsų Na jonai
+ ir Cl- yra nemokami.Ištirpusi druska dedama į indą, elektrolitinį indą ir du inertiniai platinos arba grafito elektrodai panardinami į natrio chloridą. Šie elektrodai yra prijungti prie šaltinio, generuojančio nuolatinę elektros srovę, pavyzdžiui, baterijos ar elemento.
Praėjus elektros srovei, įvyksta taip:
- Neigiamas baterijos ar elemento polius tiekia elektronus į vieną iš elektrodų, kuris tampa katodu;
- Katodas: gauna iš ląstelės elektronus ir tampa neigiamu poliu, pritraukdamas Na katijonus+, nes priešingi krūviai traukia. Šie jonai gauna elektronus iš elektrodo (katodo) ir įvyksta jų redukcija, susidarant metaliniam natriui:
Sumažinimas:At+(ℓ) + ir- → Įėjimass
Metalinis natris nusėda ant elektrodo viršaus ir siunčiamas į rezervuarą.
Nesustokite dabar... Po reklamos yra daugiau;)
- Anodas: tampa teigiamai įkrautas, pritraukdamas Cl anijonus- (todėl jis vadinamas anodu). Šie jonai praranda savo elektronus, kai jie liečiasi su anodu, todėl jie oksiduojasi, susidaro chloro atomai, kurie iškart du po du sujungia, kad susidarytų chloro dujos:
Oksidacija:2Cl-(ℓ) → 2 ir- + 1Cl2g)
Šios dujos burbuliuoja aplink anodą ir yra surenkamos stikliniu vamzdžiu, pritaikytu sistemai.
Taigi bendrą šiuo atveju vykstančią reakciją pateikia:
Katodas: 2Na+(ℓ) + 2e- → 2Nas
Anodas: 2Cl-(ℓ) → 2 ir- + 1Cl2g) ____________
Visuotinė reakcija: 2Na+(ℓ) + 2Cl-(ℓ) → 2Nas + 1Cl2g)
Kitas svarbus aspektas, apie kurį reikia žinoti ir kuris buvo pabrėžtas minėto teksto (Igneous Electrolysis) pabaigoje, yra tas, kad elektrinės srovės generavimui naudojamo elemento ar akumuliatoriaus ddp (potencialų skirtumas) turi būti lygus arba didesnis už reakcija.
Pažvelkime į tai mūsų nagrinėjamos natrio chlorido elektrolizės atveju. Norint sužinoti galimą šios reakcijos skirtumą, pakanka sumažinti standartinį katodo redukcijos potencialą anodu. Tai paaiškinta tekste. Potencialus akumuliatoriaus skirtumas .
Per standartinių redukcijos potencialų lentelę (E0raudona), mes žinome, kad:
At+(ℓ) + ir- → Įėjimass IR0raudona = -2,71
2Cl-(ℓ) → 2 ir- + 1Cl2g) IR0raudona = +1,36
Dabar tiesiog sumažinkite šias vertes, kad sužinotumėte galimą pasaulinės reakcijos skirtumą:
Ir0 = IR0raudonas (katodas) - IR0raudonas (anodas)
Ir0 = -2,71 – (+ 1,36)
Ir0 = - 4,07 V
Todėl tai reiškia, kad naudojamo elemento arba akumuliatoriaus įtampa turi būti lygi arba didesnė kaip 4,07 V, kad būtų galima atlikti magminę natrio chlorido elektrolizę.
Neigiama reikšmė rodo tik tai, kad tai nėra spontaniškas procesas.. Akumuliatorių atveju, kuris yra savaiminis procesas, elektromotorinės jėgos vertė (∆E0) visada duoda teigiamą.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. "Magminio natrio chlorido elektrolizė"; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm. Žiūrėta 2021 m. Birželio 28 d.
e) Tai yra savaiminis redoksinis procesas.
Chemija

Elektrolizės, galvanizavimo, nikelio, chromo, nikelio, chromo, katodo, natrio, aliuminio, chloro, kaustinė soda, vandenilio dujos, magminė elektrolizė, vandeninė elektrolizė, šarminiai metalai, šarminė žemė, dujos chloras.
Chemija

Elektrolizė, elektrolitų tirpalai, elektros srovė, oksidacijos-redukcijos reakcijos, savaiminis cheminis procesas, cheminis procesas neaktyvus, transformatorius, dirbtinis transformavimas, pramonė, šarminiai metalai, šarminė žemė, vandenilio dujos, dujos kl

